когда мы были шпионами
Ультибро Бризхалер капс. с пор. д/инг. 50мкг+110мкг №30
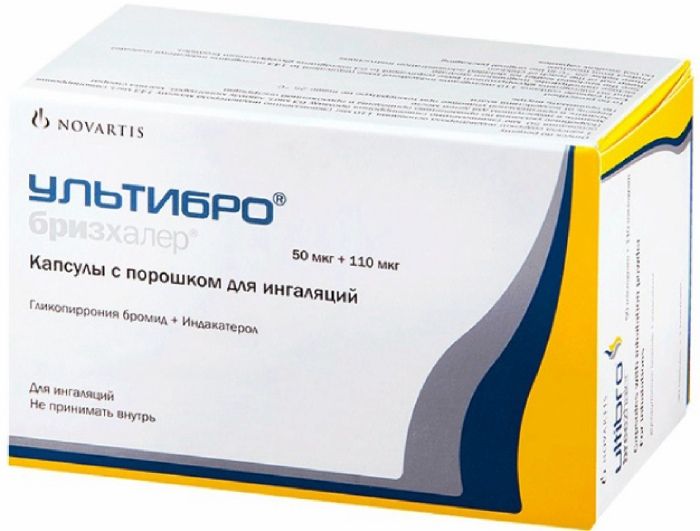
Латинское названиеULTIBRO BREEZHALERМеждународное непатентованное названиеиндакатерол (indacaterol)гликопиррония бромид (glycopyrronium bromide)Форма выпуска. Капсулы с порошком для ингаляций Упаковка 6 шт. - блистеры из ПА/Ал/ПВХ и алюминиевой фольги (5) в комплекте с устройством для ингаляций (бризхалер) - пачки картонные. Описание. Капсулы с порошком для ингаляций твердые, размер №3, прозрачные, бесцветные, с маркировкой черного цвета на крышечке и надписью "IGP110.50" синими чернилами под двойной синей полосой на корпусе; содержимое капсул - порошок белого или почти белого цвета. Показания— длительная поддерживающая терапия нарушений бронхиальной проходимости у пациентов с хронической обструктивной болезнью легких, облегчающая симптомы и снижающая количество обострений. Способ применения и дозы. Препарат представляет собой капсулы с порошком для ингаляций, которые следует применять только для ингаляций через рот с помощью специального устройства для ингаляций (бризхалер), входящего в комплект. Капсулы нельзя принимать внутрь. Капсулы с порошком для ингаляций следует хранить в блистере и извлекать из него непосредственно перед применением. Рекомендуемая доза препарата Ультибро® Бризхалер® составляет 50 мкг + 110 мкг (содержимое 1 капсулы) 1 раз/сут. Ингаляцию препарата проводят ежедневно 1 раз/сут в одно и то же время. В случае пропуска дозы ее необходимо принять как можно быстрее. Следует проинформировать пациента о недопустимости применения более 1 дозы препарата в сутки. Перед началом применения препарата пациента следует обучить правильной технике использования устройства для ингаляций. При отсутствии улучшения функции дыхания, следует удостовериться, правильно ли пациент применяет препарат. Препарат следует вдыхать, а не глотать. Состав 1 капс.гликопиррония основание 50 мкг, что соответствует гликопиррония бромиду 63 мкгиндакатерола основание 110 мкг, что соответствует индакатерола малеату 143 мкг. Противопоказания— повышенная чувствительность к гликопирронию, индакатеролу или любым другим компонентам, входящим в состав препарата;— возраст до 18 лет (эффективность и безопасность не установлены);— непереносимость галактозы, дефицит лактазы или глюкозо-галактозная мальабсорбция (препарат содержит лактозу). Не рекомендуется одновременное применение с лекарственными препаратами, содержащими другие бета 2-адреномиметики длительного действия или м-холиноблокаторы длительного действия.С осторожностью. Сопутствующие заболевания сердечно-сосудистой системы (ИБС /в т.ч. нестабильная стенокардия/, острый инфаркт миокарда (в т.ч. в анамнезе/, артериальная гипертензия, нарушения сердечного ритма, удлинение интервала QTc /QT скорректированный >0.44 с/), судорожные расстройства, тиреотоксикоз, сахарный диабет, синдром врожденного удлинения интервала QT; одновременное применение лекарственных средств, удлиняющих интервал QT(антиаритмические препараты IAи III классов, трициклические и тетрациклические антидепрессанты, нейролептики, макролиды, противогрибковые препараты, производные имидазола, некоторые антигистаминные, в т.ч. астемизол, терфенадин, эбастин), препараты для общей анестезии из группы барбитуратов; при гиперреактивности на действие бета 2-адреномиметиков; закрытоугольная глаукома, нарушения функции печени тяжелой степени, заболевания, сопровождающиеся задержкой мочи, нарушения функции почек тяжелой степени (СКФ ниже 30 мл/мин/1.73 м 2), включая терминальную стадию почечной недостаточности, требующую проведения гемодиализа (применение препарата возможно только в случае, если ожидаемая польза превышает потенциальный риск). Особые указания. Указания по применению устройства для ингаляций. Каждая упаковка препарата Ультибро® Бризхалер® содержит одно устройство для ингаляций (бризхалер) и блистеры с капсулами с порошком для ингаляций. Капсулы с порошком для ингаляций нельзя принимать внутрь. Устройство для ингаляций, находящееся в упаковке, предназначено для использования только вместе с капсулами препарата Ультибро® Бризхалер®. Для ингаляции капсул, находящихся в упаковке, используется только бризхалер. Не следует использовать капсулы препарата Ультибро® Бризхалер® с каким-либо другим устройством для ингаляций и, в свою очередь, не следует использовать бризхалер для ингаляции других препаратов. Через 30 дней использования бризхалер следует утилизировать. Как использовать устройство для ингаляций 1. Снять крышку.2. Открыть устройство для ингаляций, для чего следует крепко взять его за основание и наклонить мундштук.3. Приготовить капсулу: отделить один блистер от блистер-упаковки, оторвав ее по перфорации. Взять один блистер и снять с него защитную пленку, чтобы извлечь капсулу. Не нажимать на блистер, чтобы извлечь капсулу.4. Вынуть капсулу. Капсулы следует хранить в блистере и вынимать только непосредственно перед применением. Вытереть руки насухо и извлечь капсулу из блистера. Не следует глотать капсулу.5. Вставить капсулу в бризхалер: положить капсулу в камеру для капсул. Никогда не класть капсулу непосредственно в мундштук.6. Плотно закрыть бризхалер. Когда он закроется до конца, должен раздаться щелчок.7. Проколоть капсулу: следует удерживать бризхалер в вертикальном положении так, чтобы мундштук был направлен вверх. Одновременно нажать до конца на обе кнопки. При прокалывании капсулы должен раздаться щелчок. Не следует нажимать на кнопки для прокалывания капсулы более одного раза.8. Полностью отпустить кнопки бризхалера с обеих сторон.9. Перед тем как вставить мундштук в рот, следует сделать полный выдох. Не следует дуть в мундштук.10. Вложить мундштук бризхалера в рот и плотно сжать губы вокруг него. Держа бризхалер рукой, сделать быстрый равномерный максимально глубокий вдох. Не следует нажимать на кнопки прокалывающего устройства.11. Когда пациент делает вдох через устройство для ингаляций, должен раздаться характерный дребезжащий звук, создаваемый вращением капсулы в камере и распылением порошка. Пациент может почувствовать сладковатый привкус препарата во рту. Если дребезжащего звука не слышно, это может означать, что капсула застряла в камере бризхалера. В этом случае следует открыть бризхалер и аккуратно освободить капсулу, постучав по основанию устройства. Чтобы освободить капсулу, не следует нажимать на кнопки для прокалывания капсулы. При необходимости следует повторить этапы 9 и 10.12. Если при вдыхании пациент услышал характерный звук, необходимо задержать дыхание как можно дольше (чтобы не испытывать неприятных ощущений), и в это же время вынуть мундштук изо рта. После этого сделать выдох. Затем следует открыть бризхалер и посмотреть, не остался ли в капсуле порошок. Если в капсуле остался порошок, необходимо закрыть бризхалер и повторить этапы 9-12. Большинство людей могут опорожнить капсулу за 1 или 2 ингаляции. У некоторых людей в течение небольшого времени после ингаляции лекарственного препарата отмечается кашель. Если появляется кашель, не следует волноваться. Если порошка в капсуле не осталось, значит, пациент получил полную дозу препарата.13. После того как принята суточная доза препарата Ультибро® Бризхалер®, следует, отклонив мундштук, вынуть пустую капсулу, постучав по устройству для ингаляций, и утилизировать ее. Опустить мундштук бризхалера и закрыть его крышкой. Не следует хранить капсулы в бризхалере. Памятка для пациента. Не следует глотать капсулы с порошком для ингаляций. Необходимо использовать только бризхалер, находящийся в упаковке. Капсулы следует хранить в блистере и извлекать непосредственно перед использованием. Никогда не следует вкладывать капсулу в мундштук бризхалера. Не следует нажимать на прокалывающее устройство более одного раза. Никогда не следует дуть в мундштук бризхалера. Следует всегда прокалывать капсулу до ингаляции. Не следует мыть бризхалер, необходимо хранить его сухим. Не следует разбирать бризхалер. Начиная новую упаковку препарата, для ингаляции капсул следует всегда использовать новый бризхалер, находящийся в упаковке. Не следует хранить капсулы в бризхалере. Необходимо всегда хранить блистеры с капсулами и бризхалер в сухом месте. Дополнительная информацияВ очень редких случаях маленькие кусочки капсул могут попасть в рот. Пациенту не следует волноваться, если он вдохнул их или проглотил. Для того, чтобы свести данное явление к минимуму, не следует прокалывать капсулу более 1 раза. Как чистить бризхалер. Следует чистить бризхалер 1 раз в неделю. Мундштук протирают снаружи и внутри чистой сухой тканью. Никогда не использовать воду для чистки бризхалера, необходимо сохранять его сухим. Побочные эффекты. Инфекционные и паразитарные заболевания: очень часто - инфекция верхних дыхательных путей; часто - назофарингит, инфекция мочевыводящих путей, синусит, ринит. Со стороны иммунной системы: часто - гиперчувствительность. Со стороны обмена веществ: часто - гипергликемия и сахарный диабет. Психические нарушения: нечасто - бессонница. Со стороны нервной системы: часто - головокружение, головная боль; редко - парестезия. Со стороны органа зрения: нечасто - глаукома 1. Со стороны сердечно-сосудистой системы: нечасто - ИБС, мерцательная аритмия, тахикардия, ощущение сердцебиения. Со стороны дыхательной системы: часто - кашель, боль в ротоглотке, першение в горле; нечасто - носовое кровотечение. Со стороны пищеварительной системы: часто - диспепсия, кариес зубов; нечасто - сухость слизистой оболочки полости рта, гастроэнтерит. Со стороны кожи и подкожных тканей: нечасто - кожная сыпь/зуд. Со стороны костно-мышечной системы: нечасто - боль в мышцах и костях; мышечный спазм, боль в конечностях, миалгия. Со стороны мочевыделительной системы: часто - обструкция мочевого пузыря, задержка мочи. Общие реакции: часто - лихорадка 1, боль в грудной клетке; нечасто - периферические отеки, усталость.1 - НЯ, отмечавшиеся на фоне применения комбинированного препарата Ультибро® Бризхалер® и не отмечавшиеся при применении каждого из компонентов при монотерапии. Во время проведения пострегистрационных исследований были выявлены следующие побочные реакции (поскольку сообщения получены в добровольном порядке от популяции неопределенного размера, достоверно определить частоту развития данных НЯ не представляется возможным, в связи с чем они классифицированы как частота неизвестна).НЯ сгруппированы в соответствии с классификацией органов и систем органов MedDRA.В пределах каждой группы НЯ указаны в порядке уменьшения их тяжести. Со стороны иммунной системы: ангионевротический отек. Со стороны дыхательной системы: дисфония. Описание отдельных неблагоприятных побочных реакций. Из НЯ, типичных для М-холиноблокаторов, наиболее часто отмечалась сухость во рту (0.64% против 0.45% в группе плацебо); вместе с тем, на фоне применения препарата Ультибро® Бризхалер® это НЯ отмечалось реже, чем на фоне применения гликопиррония при монотерапии. В большинстве случаев сухость во рту была слабо выражена и связана с применением препарата, тяжелых случаев отмечено не было. Кашель отмечался часто, но, как правило, был легкой степени выраженности. Некоторые серьезные НЯ, включая реакции гиперчувствительности и ИБС, были отмечены в качестве НЯ на фоне применения индакатерола при монотерапии. У пациентов в группе применения препарата Ультибро® Бризхалер® реакции гиперчувствительности и ИБС отмечались с частотой 2.06%, (0% в группе плацебо) и 0.67% (0.78% в группе применения плацебо) соответственно. Если любые из указанных в инструкции побочных эффектов усугубляются или отмечаются любые другие побочные эффекты, не указанные в инструкции, пациенту следует сообщить об этом врачу
2183 Руб.Випдомет таб. п/о 12,5+1000мг №56

Показания Сахарный диабет 2 типа (СД2) у взрослых пациентов в возрасте от 18 лет и старше для улучшения гликемического контроля в дополнение к диетотерапии и физическим нагрузкам: в качестве монотерапии у пациентов, не достигших адекватного контроля гликемии на фоне монотерапии метформином, или в качестве замещения у тех, кто уже получает комбинированное лечение метформином и алоглиптином в виде монопрепаратов; в комбинации с пиоглитазоном (тройная комбинация: метформин + алоглиптин + пиоглитазон), когда терапия метформином и пиоглитазоном не приводит к адекватному контролю гликемии; в комбинации с инсулином (тройная комбинация: метформин + алоглиптин + инсулин), когда терапия инсулином и метформином не приводит к адекватному контролю гликемии. Противопоказания Противопоказания гиперчувствительность к алоглиптину или метформину или к любому вспомогательному веществу, или серьезные реакции гиперчувствительности к любому ДПП-4 ингибитору в анамнезе, в т.ч. анафилактические реакции, анафилактический шок и ангионевротический отек; сахарный диабет 1 типа; любой тип острого метаболического ацидоза: лактоацидоз (в т.ч. в анамнезе), диабетический кетоацидоз; диабетическая прекома, кома; почечная недостаточность средней или тяжелой степени (КК менее 60 мл/мин); острые состояния, протекающие с риском развития нарушений функции почек: дегидратация (повторная рвота, диарея); лихорадка, тяжелые инфекционные заболевания; состояния гипоксии (шок, сепсис, инфекции почек, бронхолегочные заболевания); клинически выраженные проявления острых и хронических заболеваний/состояний, которые могут приводить к тканевой гипоксии (в т.ч. острая и хроническая сердечная недостаточность с нестабильными показателями гемодинамики, дыхательная недостаточность, острый инфаркт миокарда); печеночная недостаточность, нарушение функции печени; острая алкогольная интоксикация, хронический алкоголизм; соблюдение гипокалорийной диеты (менее 1000 ккал/сут); применение в течение менее 48 ч до и в течение 48 ч после проведения радиоизотопных или рентгенологических исследований с внутрисосудистым введением йодсодержащего контрастного вещества; обширные хирургические операции и травмы, когда показано проведение инсулинотерапии; беременность; период грудного вскармливания; возраст до 18 лет в связи с отсутствием данных по эффективности и безопасности; совместное применение с производными сульфонилмочевины в связи с отсутствием данных по эффективности и безопасности. С осторожностью: у пациентов в возрасте старше 60 лет, выполняющих тяжелую физическую работу, что связано с повышенным риском развития у них лактоацидоза; применение препарата Випдомет® в комбинации с пиоглитазоном; у пациентов с панкреатитом в анамнезе. Беременность Беременность Данные о безопасности применения препарата Випдомет® у беременных женщин отсутствуют. Исследования на беременных крысах показали токсичность комбинированной терапии алоглиптином и метформином на репродуктивную систему при введении доз примерно в 5-20 раз превосходящих рекомендованные дозы для человека (для метформина и алоглиптина соответственно). Применение препарата Випдомет® во время беременности противопоказано. Алоглиптин Данные о безопасности применения алоглиптина у беременных женщин отсутствуют. Исследования на животных не показали прямого или непрямого негативного воздействия алоглиптина на репродуктивную систему. Метформин Ограниченное количество данных свидетельствует о том, что прием метформина у беременных женщин не увеличивает риск развития врожденных пороков у детей. Исследования на животных не показали прямого или непрямого негативного воздействия метформина в клинически значимых дозах на репродуктивную систему. Период грудного вскармливания Отсутствуют данные о проникновении в грудное молоко у животных алоглиптина и метформина при комбинированной терапии. При монотерапии алоглиптином или метформином исследования на животных показали, что алоглиптин и метформин проникают в молоко лактирующих крыс. Нет данных по проникновению алоглиптина в грудное молоко человека. Метформин проникает в грудное молоко у женщин в небольших количествах, поэтому нельзя исключить риск возникновения побочных эффектов у грудных детей. В связи с этим применение препарата в период грудного вскармливания противопоказано. Применение и дозы Препарат принимают внутрь. Випдомет® назначают по 1 таб. 2 раза/сут одновременно с приемом пищи с целью уменьшения нежелательных реакций со стороны ЖКТ. Таблетки следует проглатывать целиком, не разжевывая, запивая водой. В случае если пациент пропустил прием препарата Випдомет®, следует принять его сразу после того, как вспомнит о пропущенном приеме препарата. Не следует принимать двойную дозу препарата Випдомет®, в данном случае прием дозы следует пропустить. Дозу препарата Випдомет® подбирают индивидуально. Для пациентов, не достигших адекватного контроля гликемии при монотерапии метформином рекомендуемая доза препарата Випдомет® составляет 1 таб. 12.5 мг + 500 мг или 12.5 мг + 1000 мг 2 раза/сут в зависимости от уже принимаемой дозы метформина, что соответствует 25 мг алоглиптина и 1000 мг или 2000 мг метформина в сутки. Для пациентов, не достигших адекватного контроля гликемии при комбинированной терапии метформином и пиоглитазоном в максимально переносимой дозе препарат Випдомет® назначают в дополнение к пиоглитазону, при этом принимаемая доза пиоглитазона должна быть сохранена. Рекомендуемая доза препарата Випдомет® составляет 1 таб. 12.5 мг + 500 мг или 12.5 мг + 1000 мг 2 раза/сут в зависимости от уже принимаемой дозы метформина, что соответствует 25 мг алоглиптина и 1000 мг или 2000 мг метформина в сутки. При проведении данной терапии следует соблюдать осторожность в связи с риском развития гипогликемии. В случае развития гипогликемии возможно рассмотрение снижения применяемых доз метформина или пиоглитазона. В качестве замещения у пациентов, принимающих алоглиптин и метформин в виде монопрепаратов (в качестве комбинации алоглиптина и метформина или как часть комбинации с инсулином - алоглиптин, метформин и инсулин), суточная доза алоглиптина и метформина в составе препарата Випдомет® должна соответствовать суточным дозам алоглиптина и метформина, принимаемым ранее. Разовая доза алоглиптина в составе препарата Випдомет® должна быть снижена в 2 раза (12.5 мг), поскольку таблетка принимается 2 раза/сут, при этом разовая доза метформина должна оставаться неизменной (500 мг или 1000 мг). Для пациентов, не достигших адекватного контроля гликемии на фоне терапии комбинацией метформина в максимально переносимой дозе и инсулина, доза препарата Випдомет® должна обеспечивать прием алоглиптина в дозе 12.5 мг 2 раза/сут (общая суточная доза алоглиптина 25 мг) и прием метформина в ранее принимаемой дозе. Во избежание риска развития гипогликемии возможно снижение дозы инсулина. Максимальная рекомендованная суточная доза препарата Випдомет® составляет 2 таблетки (25 мг алоглиптина). Не требуется коррекции дозы препарата Випдомет® у пожилых пациентов в возрасте 65 лет. Следует проявлять осторожность при подборе доз алоглиптина ввиду возможного нарушения функции почек у данной группы пациентов. Данные по эффективности и безопасности применения препарата у пациентов в возрасте до 18 лет отсутствуют. У пациентов с почечной недостаточностью легкой степени тяжести (КК 60 мл/мин) не требуется коррекции дозы препарата Випдомет®. Препарат Випдомет® не рекомендуется применять у пациентов с почечной недостаточностью средней степени тяжести (КК в интервале 30 до < 60 мл/мин), поскольку данным пациентам показана меньшая дозировка алоглиптина, чем представлена в фиксированной комбинации препарата Випдомет®. Пациентам с почечной недостаточностью рекомендуется проводить оценку скорости клубочковой фильтрации (СКФ) до начала лечения препаратом Випдомет® и затем минимум 1 раз в год в процессе лечения. У пациентов с риском прогрессирования нарушения функции почек и у пациентов пожилого возраста функцию почек следует оценивать чаще, например, каждые 3-6 месяцев. Побочные эффекты и передозировка Побочные эффекты: Частота нежелательных реакций препарата расценивается следующим образом: очень часто ( 1/10); часто ( 1/100, 400 мл/мин, что указывает на то, что метформин выводится за счет клубочковой фильтрации и канальцевой секреции. После перорального приема Т1/2 составляет около 6.5 ч. Фармакокинетика у отдельных групп пациентов При нарушенной функции почек клиренс метформина снижается пропорционально КК, увеличивается Т1/2, что может приводить к увеличению концентрации метформина в плазме. Особые указания Лактоацидоз является редким, но серьезным (высокая смертность при отсутствии неотложного лечения) осложнением, которое может возникнуть из-за кумуляции метформина. Случаи лактоацидоза при приеме метформина возникали в основном у пациентов с сахарным диабетом с тяжелой почечной недостаточностью. Следует учитывать и другие сопряженные факторы риска, такие как декомпенсированный сахарный диабет, кетоз, продолжительное голодание, алкоголизм, печеночная недостаточность и любое состояние, связанное с выраженной гипоксией. Это может помочь снизить частоту случаев возникновения лактоацидоза. Следует учитывать риск развития лактоацидоза при появлении неспецифических признаков, таких как мышечные судороги, сопровождающиеся диспепсическими расстройствами и/или болью в животе и/или выраженной астенией. Лактоацидоз характеризуется ацидотической одышкой и гипотермией с последующей комой. Диагностическими лабораторными показателями являются снижение pH крови (менее 7.25), концентрация лактата в плазме крови свыше 5 ммоль/л, повышенные анионный промежуток и отношение лактат/пируват. При подозрении на лактоацидоз необходимо прекратить прием препарата и немедленно обратиться к врачу. Функция почек Алоглиптин и метформин преимущественно выводятся почками. Риск лактоацидоза, связанного с приемом метформина, повышается по мере увеличения степени нарушения функции почек, поэтому перед началом лечения и регулярно в последующем необходимо определять КК: не реже 1 раза в год у пациентов с нормальной функцией почек, и 2-4 раза в год у пожилых пациентов, а также у пациентов с КК на нижней границе нормы. Следует проявлять особую осторожность при возможном нарушении функций почек у пожилых пациентов при одновременном применении гипотензивных препаратов, диуретиков или НПВП. Печеночная недостаточность Нет клинических данных о применении препарата Випдомет® у пациентов с тяжелой печеночной недостаточностью (более 9 баллов по шкале Чайлд-Пью). Применение препарата у таких групп пациентов не рекомендуется. Хирургические операции Применение метформина должно быть прекращено за 48 ч до проведения плановых хирургических операций и может быть продолжено не ранее чем через 48 ч после при условии, что в ходе обследования функция почек была признана нормальной. Применение с другими гипогликемическими лекарственными средствами Препарат Випдомет® не рекомендуется применять в сочетании с производными сульфонилмочевины, поскольку безопасность и эффективность не исследовались. С целью уменьшения риска развития гипогликемии рекомендуется снижение дозы инсулина и пиоглитазона при одновременном применении с препаратом Випдомет®. Изменение клинического статуса пациента с адекватно контролируемым ранее СД2 При проявлении лабораторных отклонений или клинических симптомов заболевания у пациентов с прежде адекватно контролируемым СД2 на фоне лечения препаратом Випдомет®, у пациентов следует незамедлительно исключить в первую очередь кетоацидоз или лактацидоз по результатам анализа крови на электролиты и кетоны, плазменную концентрацию глюкозы, а также pH крови, концентрации лактата и пирувата, а также плазменную концентрацию метформина. При развитии ацидоза любой этиологии дальнейший прием препарата Випдомет® отменяют и предпринимают меры по коррекции ацидоза. Острый панкреатит В обобщенном анализе 13 клинических исследований применения алоглиптина в дозе 25 мг/сут, 12.5 мг/сут, препарата сравнения и плацебо частота развития острого панкреатита составила 2, 1, 1 или 0 случаев на 1000 пациенто-лет в каждой группе соответственно. В исследовании сердечно-сосудистых исходов частота выявления острого панкреатита у пациентов, проходивших лечение алоглиптином или плацебо, составила 3 и 2 случая на 1000 пациенто-лет соответственно. Пациенты должны быть проинформированы о характерных симптомах острого панкреатита: стойкая, сильная боль в животе, которая может иррадиировать в спину. При подозрении на развитие острого панкреатита прием препарата Випдомет® прекращают; при подтверждении развития острого панкреатита прием препарата не возобновляют. Нет данных о том, существует ли повышенный риск развития панкреатита на фоне приема препарата алоглиптина у пациентов с панкреатитом в анамнезе. Поэтому пациентам с панкреатитом в анамнезе следует соблюдать осторожность. Влияние на функцию печени Были получены постмаркетинговые сообщения о нарушениях функции печени, включая печеночную недостаточность при приеме алоглиптина. Их связь с применением препарата не была установлена. Однако пациентов необходимо тщательно обследовать на наличие возможных отклонений функциональных проб печени. Если обнаружены отклонения в функциональных пробах печени и альтернативная этиология их возникновения не установлена, следует рассмотреть прекращение лечения препаратом. Влияние на способность управлять транспортными средствами: Препарат Випдомет® не оказывает или оказывает незначительное влияние на способность управлять транспортными средствами и механизмами. Тем не менее, необходимо учитывать риск развития гипогликемии при применении препарата в сочетании с другими гипогликемическими препаратами (инсулином или пиоглитазоном) и соблюдать осторожность при управлении транспортными средствами и механизмами. Условия хранения и отпуска из аптек Условия хранения:Хранить при температуре не выше 25 °С. Хранить в недоступном для детей месте. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Випдомет® Международное непатентованное название:Алоглиптин+Метформин. Форма выпуска:таблетки, покрытые пленочной оболочкой. Состав: АТХ: Регистрация: Лекарственное средство Фармгруппа: Гипогликемическое средство для перорального применения комбинированное (дипептидилпептидазы-4 ингибитор+бигуанид)Срок годности:3 года. Не применять по истечении срока годности. Владелец рег.удостоверения:Такеда Фармасьютикалс США, Инк. Производитель:TAKEDA IRELAND, Ltd. Представительство:Такеда Фармасьютикалс ООО. Информация предоставлена
1755 Руб.Зоэли таб. п/о 2.5мг+1.5мг №28
Показания Контрацепция. Противопоказания Противопоказания Комбинированные гормональные контрацептивы (КГК) не следует применять при наличии любого из перечисленных ниже cостояний/заболеваний. Отсутствуют эпидемиологические данные о применении КОК, содержащих 17ß-эстрадиол, однако противопоказания к применению препарата Зоэли® соответствуют противопоказаниям к применению КГК, содержащих этинилэстрадиол. В случае возникновения любого из этих состояний/заболеваний в период применения препарата Зоэли® следует немедленно прекратить прием препарата- Тромбоз глубоких вен или тромбоэмболия легочной артерии, в том числе в анамнезе- Артериальные тромбозы (инфаркт миокарда) или продромальные состояния (транзиторная ишемическая атака, стенокардия), в том числе в анамнезе- Острые нарушения мозгового кровообращения, в том числе в анамнезе- Мигрень с очаговыми неврологическими симптомами, в том числе в анамнезе- Выраженные или множественные факторы риска венозных или артериальных тромбозов (см. раздел "Особые указания"), такие как: - сахарный диабет с сосудистыми симптомами: - неконтролируемая артериальная гипертензия: - тяжелая дислипопротеинемия: - ожирение (индекс массы тела более 30 кг/м 2)- длительная иммобилизация- любая операция на нижних конечностях или серьезная травма- осложненные пороки сердца- фибрилляция предсердий- курение в возрасте старше 35 лет- Обширное оперативное вмешательство с длительной иммобилизацией (см. раздел "Особые указания")- Наследственная или приобретенная предрасположенность к развитию венозного или артериального тромбоза, например, резистентность к активированному протеину С, дефицит антитромбина III, дефицит протеинов С и S, гипергомоцистеинемия и антифосфолипидные антитела (антитела к кардиолипину, волчаночный антикоагулянт)- Панкреатит с тяжелой гипертриглицеридемией, в том числе в анамнезе- Тяжелые заболевания печени, в том числе в анамнезе, до нормализации показателей функции печени- Опухоли печени (злокачественные или доброкачественные), в том числе в анамнезе- Известные или предполагаемые гормонозависимые злокачественные опухоли (например, половых органов или молочной железы)- Установленная или предполагаемая беременность, период грудного вскармливания- Гиперчувствительность к любому действующему или вспомогательному веществу- Дефицит лактазы, непереносимость лактозы, глюкозо-галактозная мальабсорбция- Кровотечения из влагалища неясной этиологии- Постменопауза. Отсутствуют данные об эффективности п безопасности применения препарата Зоэли® у девочек-подростков в возрасте до 18 лет. Имеющаяся информация по фармакокинетике представлена в разделе "Фармакокинетика". С осторожностью: При наличии любых из перечисленных ниже состояний, заболеваний, факторов риска следует оценить пользу от применения препарата Зоэли® и возможные риски для каждой отдельной женщины. Это следует обсудить с женщиной еще до того, как она начнет прием препарата Зоэли®. Дополнительная информация содержится в разделе "Особые указания". В случаях ухудшения, обострения или возникновения впервые любого из этих состояний, заболеваний, факторов риска женщине следует обратиться к врачу для решения вопроса о возможности дальнейшего применения препарата Зоэли®- Сахарный диабет без поражения сосудов- Тяжелая депрессия или наличие этого заболевания в анамнезе- Системная красная волчанка- Болезнь Крона- Язвенный колит- Нарушения функции печени- Гипертриглицеридемия, в том числе в семейном анамнезе- Факторы риска ишемической болезни сердца (ожирение, артериальная гипертензия)- Наличие в семейном анамнезе венозных тромбозов, артериальной эмболии у братьев, сестер или у родителей в молодом возрасте (см. раздел "Особые указания"). Беременность Беременность Применение препарата Зоэли® противопоказано в период беременности. В случае возникновения беременности при применении препарата Зоэли® следует прекратить прием препарата. В большинстве эпидемиологических исследований не было выявлено увеличения риска развития врожденных пороков у детей, чьи матери до беременности принимали КОК, содержащие этинилэстрадиол. При случайном приеме в начале беременности КОК. содержащих этинилэстрадиол, не было отмечено тератогенных эффектов. Имеется ограниченный опыт применения препарата Зоэлн® у беременных женщин, который свидетельствует об отсутствии нежелательного влияния препарата на состояние плода или новорожденного. В исследованиях комбинации номегэстрола ацетат/ эстрадиол на лабораторных животных была зафиксирована репродуктивная токсичность. Препарат Зоэли® предназначен для предупреждения нежелательной беременности. Если женщина хочет прекратить прием препарата Зоэли®, чтобы забеременеть, следует принять во внимание, что овуляция восстанавливается в среднем через 20,8 дней после последнего приема таблетки препарата Зоэли® (см. раздел "Фармакологические свойства", подраздел "Фармакодинамика"). Период грудного вскармливания КОК могут оказывать влияние на лактацию, гак как они вызывают изменение количества и состава грудного молока. Следовательно, применение КОК не рекомендуется до полного прекращения кормления грудью (следует подобрать альтернативный метод контрацепции). Небольшие количества контрацептивных половых гормонов и/или их метаболитов могуг выводиться с грудным молоком, однако данных об их нежелательном влиянии на здоровье новорожденного нет. Применение и дозы Препарат предназначен для приема внутрь. Как следует принимать препарат Зоэли®Таблетки принимают ежедневно в одно н то же время дня независимо от приема пищи в порядке, указанном на упаковке, при необходимости запивая небольшим количеством воды. Следует принимать по одной таблетке в день в течение 28 дней подряд. Прием следует начинать с белых таблеток, содержащих действующие вещества. Белые таблетки, содержащие действующие вещества, принимают в течение первых 24 дней. В течение последующих 4 дней принимают желтые таблетки, не содержащие действующих веществ (плацебо). Прием таблеток из каждой последующей упаковки следует начинать на следующий день после приема последней таблетки из предыдущей упаковки, независимо от наличия или отсутствия кровотечения "отмены". Кровотечение "отмены" обычно начинается через 2-3 дня после приема последней белой таблетки и может не прекратиться к началу приема таблеток из следующей упаковки. Дополнительная информация представлена в разделе "Особые указания", подраздел "Изменения характера менструаций". Особые группы пациентов Нарушение функции почек. Данные о применении у пациентов с почечной недостаточностью отсутствуют, однако влияние почечной недостаточности на выведение номегэстрола ацетата и эстрадиола маловероятно. Нарушение функции печени Влияние заболеваний печени на фармакокинетику препарата Зоэли® не изучалось. Однако поскольку у пациенток с нарушением функции печени возможно ухудшение метаболизма половых гормонов, применение препарата Зоэли® у данной группы пациенток не рекомендуется до нормализации показателей функции печени (см. раздел "Противопоказания"). Как следует начинать прием препарата Зоэли® В предыдущем цикле гормональные контрацептивы не применялись. Прием таблеток следует начать в первый день менструального цикла женщины (в первый день менструального кровотечения). В этом случае применение дополнительных контрацептивных средств не требуется. Можно начать прием таблеток и со 2-5-го дня цикла. В таком случае в течение первых 7 дней приема таблеток рекомендуется дополнительно использовать барьерный метод контрацепции. Переход с комбинированного гормонального контрацептива (КОК, вагинального кольца или трансдермального пластыря)Женщине желательно начать прием препарата Зоэли® на следующий день после приема последней таблетки, содержащей действующие вещества, но не позднее чем на следующий день после завершения обычного интервала между циклами или приема таблеток плацебо. Если женщина пользовалась вагинальным кольцом или трансдермальным пластырем, то начинать прием препарата Зоэли® желательно в день их удаления, но не позднее чем в день, когда следовало бы ввести повое кольцо или наклеить очередной пластырь. Переход с препаратов, содержащих только прогестаген (таблетки, имплантаты, инъекционные формы или гормоносодержащие внутриматочные системы (ВМС)Женщина может в любой день прекратить прием таблеток, содержащих только прогестаген, и на следующий день начать прием препарата Зоэли®. Имплантат или ВМС можно удалить в любой день. В таком случае прием препарата Зоэли® следует начать в день их удаления. Если женщина получала инъекции, то прием препарата Зоэли® начинают в день, когда следовало произвести очередную инъекцию. Во всех этих случаях женщине следует рекомендовать дополнительно пользоваться барьерным методом контрацепции в течение первых 7 дней приема таблеток, содержащих действующие вещества. После аборта в первом триместре беременности. Женщина может начать прием препарата сразу же. В этом случае нет необходимости в дополнительном методе контрацепции. После родов или аборта во втором триместре беременности Для кормящих грудью женщин см. раздел "Применение при беременности и в период грудного вскармливания". При отсутствии грудного вскармливания прием препарата можно начать между 21-м и 28-м днем после родов или аборта во втором триместре беременности. При более позднем начале приема препарата женщине следует рекомендовать применять дополнительный барьерный метод контрацепции в течение первых 7 дней приема таблеток. Однако если после родов или аборта уже были половые контакты, перед началом приема препарата Зоэли® необходимо исключить беременность или дождаться первой менструации. При возобновлении приема препарата Зоэли® необходимо принимать во внимание повышение риска развития венозной тромбоэмболии (ВТЭ) в послеродовом периоде (см. раздел "Особые указания"). Что делать в случае пропуска таблеток Приведенные ниже рекомендации касаются только пропуска приема белых таблеток, содержащих действующие вещества. Если женщина принимает очередную таблетку с опозданием менее 12 часов, то контрацептивный эффект не снижается. Женщине следует принять таблетку как можно скорее, как только она об этом вспомнит. Последующие таблетки необходимо принимать в обычное время. Если женщина принимает таблетку, содержащую действующие вещества, с опозданием более 12 часов, то контрацептивный эффект может снизиться. При пропуске приема таблеток целесообразно выполнять два правила- чтобы добиться адекватного подавления гипоталамо-гипофизарно-яичниковой системы, белые таблетки, содержащие действующие вещества, необходимо принимать в течение по крайней мере 7 дней подряд- чем больше пропущено белых таблеток, содержащих действующие вещества, и ближе время приема 4 желтых таблеток плацебо, тем выше риск наступления беременности. Рекомендации при пропуске приема таблеток. Если пропущен прием одной белой таблетки, содержащей действующие вещества. Контрацептивный эффект не снижен. Женщина должна принять последнюю пропущенную белую таблетку, как только она об этом вспомнит, даже если ей придется принять одновременно две таблетки. Затем таблетки следует принимать как обычно. Дополнительные контрацептивные меры не требуются. Если пропущен прием двух или более белых таблеток. Если после пропуска приема двух или более белых таблеток, содержащих действующие вещества, отсутствовало кровотечение "отмены" во время приема желтых таблеток плацебо, то следует исключить беременность (см. также раздел "Особые указания", подраздел "Изменения характера менструаций"). Дни 1-7. Женщина должна принять последнюю пропущенную белую таблетку, как только она об этом вспомнит, даже если ей придется принять одновременно две таблетки. Затем таблетки следует принимать как обычно. При этом в течение первой недели непрерывного приема белых таблеток необходимо пользоваться барьерным методом контрацепции. Если в течение предыдущих 7 дней имел место половой акт. то следует учитывать возможность наступления беременности. Дни 8-17. Женщина должна принять последнюю пропущенную белую таблетку, как только она об этом вспомнит, даже если ей придется принять одновременно две таблетки. Затем таблетки следует принимать как обычно. При этом в течение следующих 7 дней приема белых таблеток необходимо пользоваться барьерным методом контрацепции. Дни 18-24. Риск снижения контрацептивного эффекта повышается с приближением начала приема желтых таблеток плацебо. Однако изменение схемы приема таблеток позволяет избежать снижения контрацептивного действия. Женщина должна принять последнюю пропущенную белую таблетку, как только она об этом вспомнит, даже если ей придется принять одновременно две таблетки. Нельзя одновременно принимать больше двух белых таблеток, содержащих действующие вещества. И течение следующих 7 дней приема белых таблеток необходимо пользоваться барьерным методом контрацепции, а следующую упаковку начать сразу же после окончания белых таблеток из предыдущей упаковки, т. е. женщине не следует принимать желтые таблетки плацебо. В этом случае кровотечение "отмены" обычно наступает во время приема желтых таблеток из следующей упаковки, однако во время приема белых таблеток могут наблюдаться "прорывные" кровотечения или "мажущие" выделения. Если женщина не уверена в числе пропущенных таблеток или их цвете и. соответственно.не знает, какие рекомендации ей следует выполнять, го необходимо пользоваться барьерным методом контрацепции до того момента, как женщина примет в течение 7 последовательных дней белые таблетки. Если пропущен прием желтых таблеток плацебо. Контрацептивный эффект не снижен. Женщина может не принимать желтые таблетки из последнего (четвертого) ряда блистера. Однако пропущенные таблетки следует выбросить, чтобы избежать непреднамеренного увеличения длительности фазы плацебо. Рекомендации в случае желудочно-кишечных расстройств В случае желудочно-кишечных расстройств (например, рвоты или диареи) всасывание препарата может быть неполным, поэтому следует прибегнуть к дополнительным мерам контрацепции. Если рвота возникает в течение 3-4 ч после приема таблетки, то ее прием следует считать пропущенным. Если пропущен прием одной белой таблетки, то контрацептивный эффект не снижен. Если на следующий день или дни вновь развивается рвота, то необходимо выполнять рекомендации по пропуску двух и более таблеток (см. "Рекомендации при пропуске приема таблеток"). Если женщина не хочет менять обычную схему приема таблеток, то она должна принять дополнительно белую таблетку (или таблетки) из другой упаковки. Как сдвинуть или отсрочить насту плен не менструальноподобного кровотечения. Чтобы отсрочить наступление менструальноподобного кровотечения, женщине следует продолжать прием белых таблеток из другой упаковки без приема желтых таблеток. Белые таблетки из второй упаковки можно продолжать принимать до тех пор, пока они не закончатся. После завершения приема желтых таблеток из второй упаковки необходимо возобновить прием препарата Зоэли® по обычной схеме. При удлиненной схеме приема могут наблюдаться "прорывные" кровотечения или "мажущие" выделения. Для того чтобы сместить день начала менструальноподобного кровотечения на другой день, можно сократить фазу приема желтых таблеток плацебо (максимальная длительность приема желтых таблеток плацебо - 4 дня). Чем короче перерыв, тем выше риск отсутствия менструальноподобного кровотечения "отмены" и возникновения "прорывных" кровотечений или "мажущих" кровянистых выделений во время приема таблеток из второй упаковки (как и в случае отсроченного наступления менструальноподобного кровотечения). Побочные эффекты и передозировка Побочные эффекты: Безопасность применения препарата Зоэли® оценивалась в ходе семи многоцентровыхклинических исследований продолжительностью до двух лет. В данные исследования были включены 3490 женщин в возраете 18-50 лет (суммарно 35028 циклов). Переносимость препарата Зоэли® хорошая, профиль безопасности сходен с таковым у других КОК. В таблице перечислены возможные нежелательные эффекты, которые были зарегистрированы при применении препарата. Частота нежелательных явлений указана в терминах "очень часто" ( 1/10), "часто" (<: 1/10, 1/100), "нечасто" (<: 1/100, 1/1000) и "редко" (<: 1/1000) в соответствии с классификацией MedDRA (синонимы или сопутствующие состояния не перечислены, однако также должны учитываться). ТАБЛИЦЪ 1 Акне представляет собой не спонтанно сообщаемое, а запрашиваемое явление, поскольку оценка проводилась при каждом визите в ходе исследования. Кроме указанных выше нежелательных явлений, при применении препарата Зоэли® сообщалось о развитии венозной тромбоэмболии, артериальной тромбоэмболии, реакциях гиперчувствительности (частота возникновения не установлена). Побочные эффекты, которые возникали при приеме КОК, содержащих этинилэстрадиол, подробно описаны в разделе "Особые указания": венозные и артериальные тромбоэмболии, повышение артериального давления, гормонозависимые опухоли (например, опухоли печени, рак молочной железы), хлоазма. У женщин с гипертриглицеридемией или соответствующим семейным анамнезом повышен риск развития панкреатита при приеме КОК. У женщин с наследственными формами ангионевротического отека экзогенные эстрогены могут вызывать или ухудшать симптомы ангионевротического отека. Передозировка: Повторное применение препарата Зоэли® в дозах, которые в 5 раз превышали рекомендуемые, и однократный прием номегэстрола ацетата в дозах, которые в 40 раз превышали рекомендуемые, не сопровождались нежелательными явлениями. Симптомы, которые могут возникнуть при передозировке: тошнота, рвота, кровянистые выделения из влагалища. Антидотов не существует. Дальнейшее лечение должно быть симптоматическим. Взаимодействие с другими ЛС: Для исключения возможного взаимодействия необходимо ознакомиться с инструкцией по применению сопутствующих препаратов. Влияние других лекарственных препаратов на препарат Зоэли® Взаимодействие пероральных контрацептивов с другими лекарственными средствами, индуцирующими ферменты, может привести к "прорывным" кровотечениям и/или снижению эффективности контрацепции. К лекарственным препаратам, индуцирующим печеночные ферменты (и следовательно, увеличивающим клиренс половых гормонов), относятся препараты, содержащие фенитоин, фенобарбитал, примидон, бозентан, карбамазепин, рифампицин, лекарственные препараты или препараты растительного происхождения, содержащие зверобой продырявленный (Hypericum perforatum), и в меньшей степени лекарственные препараты, содержащие окскарбазепин, топирамат, фелбамат и гризеофульвин. Ингибиторы протеазы ВИЧ, обладающие индуцирующей активностью (например, ритонавир и нелфинавир), и ненуклеозидные ингибиторы обратной транскриптазы (например, невирапин и эфавиренц) также могут оказывать влияние на печеночный метаболизм. Во время сопутствующего приема препаратов, индуцирующих микросомальные ферменты, и в течение 28 дней после их отмены следует пользоваться барьерным методом контрацепции. При необходимости в длительном лечении препаратами, индуцирующими микросомальные ферменты, необходимо рассмотреть использование другого метода контрацепции. Для препарата Зоэли® не проводилось исследований лекарственных взаимодействий, однако были проведены два исследования применения комбинации номегэстрола ацетата и эстрадиола в более высоких дозах (номегэстрола ацетат 3.75 мг + эстрадиол 1.5 мг) в сочетании с рифампицином и в сочетании с кетоконазолом в популяции женщин постменопаузального возраста. Сопутствующий прием рифампицина снижает AUC0- номегэстрола ацетата на 95% и увеличивает AUC0-t(last) эстрадиола на 25%. Сопутствующий прием кетоконазола (однократная доза 200 мг) не оказывает влияния на метаболизм эстрадиола, но увеличивает максимальную концентрацию (85%) и AUC0- (115%) номегэстрола ацетата, однако данные изменения появляются клинически значимыми. Предполагается, что схожие изменения могут иметь место в случае применения данных препаратов у женщин репродуктивного возраста. Влияние препарата Зоэли® на другие лекарственные препараты. Пероральные контрацептивы могут влиять на метаболизм других лекарственных средств.С осторожностью следует назначать препарат Зоэли® в сочетании с ламотриджином. Влияние препарата Зоэли® на лабораторные тесты Прием КОК может влиять на результаты некоторых лабораторных тестов, включая биохимические показатели функции печени, щитовидной железы, надпочечников и почек, концентрации (транспортных) белков в плазме (например. КСГ и фракции липидов/липопротенов), показатели углеводного обмена, показатели свертывания крови и фибрииолиза. Данные показатели обычно не выходят за границы нормальных значений. Фармакологическое действие и фармакокинетика Номегэстрола ацетат - эго высокоселективный прогестаген, являющийся производным естественного стероидного гормона прогестерона. Номегэстрола ацетат имеет выраженное сродство к человеческому рецептору прогестерона, обладает антигонадотропной активностью, антиэстрогенной активностью, опосредованной рецепторами прогестерона, умеренной антиандрогенной активностью и не обладает эстрогенной, андрогенной, глюкокортикоидной и минералокортикоидной активностью. В состав препарата Зоэли® входит 17ß-эстрадиол - эстроген, идентичный эндогенному человеческому 17ß-эстрадиолу (Е2). В отличие от этинилэстрадиола, который входит в состав других комбинированных пероральных контрацептивов (КОК), Е2 не имеет этинильной группы в 17α положении. При применении препарата Зоэли® средние концентрации Е2 сопоставимы с таковыми в начальной фолликулярной фазе и поздней фазе желтого тела менструального цикла (см. подраздел "Фармакокинетика"). Контрацептивный эффект препарата Зоэли® обусловлен комбинацией различных факторов, наиболее важными из которых являются подавление овуляции и изменение вязкости секрета шейки матки. В двух рандомизированных открытых сравнительных исследованиях эффективности и безопасности более чем 3200 женщин в возрасте 18-50 лет принимали препарат Зоэли® в течение 13 последовательных циклов и более чем 1000 женщин принимали комбинацию дроспиренон (3 мг)/ этинилэстрадиол (30 мкг) но схеме приема 21/7. В группе, принимавшей препарат Зоэли®, об увеличении массы тела сообщалось у 8,6% женщин (в группе сравнения - 5,7%), о нерегулярных кровотечениях "отмены" (преимущественно об отсутствии кровотечения "отмены") сообщалось у 10,5% женщин (в группе сравнения - 0,5%), об акне - у 15,4% женщин (в группе сравнения - 7,9%) (см. раздел "Побочное действие"). Оценка развития акне при приеме препарата Зоэли® показала, что у большинства женщин (73,1%) не наблюдалось изменений состояния по сравнению с состоянием до начала лечения, у 16,8% женщин наблюдалось улучшение состояния и у 10,1% женщин было отмечено появление или ухудшение течения акне. В клиническом исследовании препарата Зоэли®, проведенном в Европейском Союзе, Азии и Австралии, были рассчитаны следующие показатели индекса Перля для возрастной группы 18-35 лет: неэффективность метода - 0,40 (верхняя граница 95% доверительного интервала 1,03): неэффективность метода и ошибка пациента - 0,38 (верхняя граница 95% доверительного интервала 0,97). 13 клиническом исследовании препарата Зоэли®, проведенном в Соединенных Штатах Америки, Канаде и Латинской Америке, были рассчитаны следующие показатели индекса Перля для возрастной группы 18-35 лет: неэффективность метода - 1,22 (верхняя граница 95% доверительного интервала 2,18): неэффективность метода и ошибка пациента - 1,16 (верхняя граница 95% доверительного интервала 2,08). В рандомизированном открытом исследовании 32 женщины получали препарат Зоэли® на протяжении 6 циклов. После прекращения приема препарата Зоэли® овуляция восстанавливалась в среднем через 20,8 дней после последнего приема таблетки, при этом наиболее ранняя дата овуляции была зафиксирована на 16-й день. Фолиевая кислота является важным витамином на ранних сроках беременности. 13о время приема препарата Зоэли® концентрация фолиевой кислоты в плазме крови не изменяется и остается на базовом уровне в течение 6 последовательных месяцев приема препарата.В рандомизированном открытом сравнительном исследовании продолжительностью 2 года при приеме препарата Зоэли® женщинами в возрасте 21-35 лет наблюдалось отсутствие клинически значимого эффекта препарата Зоэли® на минеральную плотность костной ткани. Было проведено рандомизированное открытое сравнительное многоцентровос исследование для оценки влияния препарата Зоэли® на параметры свертывания крови, липидного профиля, метаболизма углеводов, на функциональное состояниенадпочечников и щитовидной железы, а также на концентрацию андрогенов. Шестьдесят женщин в возрасте 18-50 лет принимали препарат Зоэли® в течение 6 последовательных циклов. В клинических исследованиях было установлено, что при приеме препарата Зоэли® инсулинорезистентность и толерантность к глюкозе не изменялись, а также не было выявлено клинически значимых эффектов на метаболизм липидов и гемостаз. Прием препарата Зоэли® увеличивал концентрации белков-переносчиков тироксин-связывающего глобулина и кортикостероид-связывающего глобулина (КСГ). При приеме препарата Зоэли® незначительно увеличивалась концентрация глобулина, связывающего половые гормоны (ГСПГ), и значительно уменьшались концентрации андростендиона, дегидроэпиандростерона, общего н свободного тестостерона. В клиническом исследовании у группы женщин (n=32) после 13 циклов приема препарата Зоэли® не наблюдалось патологических изменений при гистологическом исследовании эндометрия. Фармакокинетика: Номегэстрола ацетат. Всасывание. Номегэстрола ацетат быстро всасывается после приема внутрь. После однократного приема максимальная концентрация в плазме составляет около 7 мг/мл и достигается через 2 ч. Абсолютная биодоступпость после однократного приема составляет 63%. Пища не оказывает клинически значимого влияния на биодоступность номегострола ацетата. Распределение. Номегэстрола ацетат активно связывается с альбумином (97-98%), но не связывается с ГСПГ или КСГ. Явный объем распределения номегострола ацетата в равновесном состоянии составляет 1645 ± 576 л. Метаболизм. Номегострола ацетат метаболизирусгся до нескольких неактивных гидроксилированных метаболитов под действием изоферментов цитохрома Р450 печени, в основном CYP3A4 и CYP3A5: также возможно участие в метаболизме изоферментов CYP2C8 и CYP2C19. Номегэстрола ацетат и его гидроксилированные производные подвергаются выраженному метаболизму второй фазы с образованием глюкуронидных и сульфатных конъюгатов. Клиренс в равновесном состоянии составляет 26 л/ч. Выведение. Период полувыведения (T 1/2) в равновесном состоянии составляет 46 ч (от 28 до 83 ч). Период полувыведения метаболитов не установлен. Номегэстрола ацетат выводится почками и через кишечник. Примерно 80% дозы выводится почками и через кишечник в течение 4 дней. Номегэстрола ацетат практически полностью выводится в течение 10 дней. Выведение через кишечник превышает выведение почками. Линейность. Линейность фармакокинетики в зависимости от дозы отмечалась в диапазоне 0,625-5 мг (оценивалась у женщин репродуктивного и постменопаузального возраста). Равновесное состояниеГСПГ не оказывает влияния на фармакокинетику номегэстрола ацетата. Равновесное состояние достигается через 5 дней. Средняя концентрация в равновесном состояниисоставляет 4 мг/мл. Максимальная концентрация номегэстрола ацетата в плазме составляет около 12 мг/мл и достигается через 1,5 ч после приема препарата. Взаимодействия In vitro номегэстрола ацетат не оказывает существенного индуцирующего или ингибирующего действия на изоферменты цигохрома Р450 и не взаимодействует с гликопротеином Р. Эстрадиол (Е2) Всасывание. Эстрадиол подвергается выраженному метаболизму при "первом прохождении" через печень после приема внутрь. Абсолютная биодоступность составляет около 1%. Прием пищи нс оказывает клинически значимого влияния на биодоступность эстрадиола. Распределение. Распределение экзогенного и эндогенного эстрадиола сходное. Эстрогены активно распределяются по всему организму. Их концентрации обычно выше в органах-мишенях половых гормонов. В крови эстрадиол связывается с ГСПГ (37%) и альбумином (61%) и только 1-2% эстрадиола циркулирует в несвязанном виде. Метаболизм Экзогенный эстрадиол активно биотрансформируется после приема внутрь. Метаболизм экзогенного и эндогенного эстрадиола сходный. Эстрадиол быстро превращается в несколько метаболитов в кишечнике и печени (в основном в эстрон), которые в последующем конъюгируются и подвергаются кишечно-печеночной рециркуляции. Имеется динамическое равновесие между эстрадиолом, эстроном и эстрон-сульфатом за счет активности различных ферментов, включая эстрадиолдегидрогеназы, сульфотрансферазы и арилсульфатазы. Окисление эстрона и эстрадиола происходит под действием изоферментов цитохрома Р450, в основном СYР1А2, CYP1A2 (вне печени), CYP3A4, CYP3A5, CYP1B1 и CYP2C9. Выведение Эстрадиол быстро выводится из крови. За счет метаболизма и кишечно-печеночной рециркуляции имеется большой пул циркулирующих сульфатов и глюкуронидов эстрогенов. В результате период полувыведсния эстрадиола, скорректированный с учетом исходного показателя, варьирует в широких пределах и составляет 3,6 ± 1,5 ч после внутривенного введения. Равновесное состояние Максимальная концентрация эстрадиола в плазме крови составляет около 90 мг/мл и достигается через 6 ч после приема. Средние концентрации в плазме крови - 50 мг/мл. Данные концентрации эстрадиола соответствуют таковым в начальной и поздней фазах менструального цикла. Особые группы пациентов Дети Фармакокинетика номегэстрола ацетата (первичная цель) после однократного приема внутрь препарата Зоэли® была сопоставима у здоровых девочек-подростков после наступления менархе и у взрослых женщин. Концентрация эстрадиола (вторичная цель) у девочек-подростков в сравнении со взрослыми женщинами была сопоставимой в течение первых 24 ч и ниже, чем у взрослых женщин, через 24 ч. Клиническая значимость данного результата неизвестна. Нарушение функции почек. Влияние заболеваний почек на фармакокинетику препарата Зоэли® не изучалось. Нарушение функции печени Влияние заболеваний печени на фармакокинетику препарата Зоэли® не изучалось. Однако у пациентов с нарушением функции печени возможно ухудшение метаболизма половых гормонов. Этнические группы Фармакокинетика препарата у представителей этнических групп специально не изучалась. Особые указания При наличии любых из перечисленных ниже состояний, заболеваний, факторов риска следует оценить пользу от применения препарата Зоэли® и возможные риски для каждой отдельной женщины. Это следует обсудить с женщиной еще до того, как она начнет прием препарата Зоэли®. В случаях ухудшения, обострения или возникновения впервые любого из этих состояний, заболеваний, факторов риска женщине следует обратиться к врачу для решения вопроса о возможности дальнейшего применения препарата Зоэли®. Приведенные ниже данные были получены в ходе эпидемиологических исследований при применении КГК, содержащих этинилэстрадиол. Препарат Зоэли® содержит 17ß-эстрадиол, тем не менее особые указания, касающиеся приема комбинированных контрацептивов, содержащих этинилэстрадиол, считаются применимыми и для препарата Зоэли®. Сосудистые нарушения- Применение КГК сопровождается повышением риска развития ВТЭ по сравнению с риском развития ВТЭ у пациентов, не применяющих КГК. Наибольший дополнительный риск разви тия ВТЭ наблюдается в первый год применения КГК. Риск также повышается в начале применения КГК или при возобновлении применения того же или другого КГК после перерыва в 4 и более недель. Результаты эпидемиологических исследований демонстрируют, что частота развития ВТЭ у пациенток без известных факторов риска, принимающих низкодозироваиные (<:50 мкг эти этинилэстрадиола) КГК, составляет от 3 до 12 случаев на 10000 женщин-лет (ЖЛ). Для сравнения, аналогичный параметр у небеременных пациенток, которые не принимают КГК, составляет от 1 до 5 случаев на 10000 ЖЛ, а у беременных женщин- от 5 до 20 случаев па 10000 ЖЛ (данные о беременности основаны на фактической длительности беременности в стандартных исследованиях: на основании положения, что беременность длится 9 месяцев, риск составляет от 7 до 27 случаев на 10000 ЖЛ). У женщин в послеродовом периоде риск развития ВТЭ составляет от 40 до 65 случаев иа 10000 ЖЛ. ВТЭ может привести к летальному исходу в 1-2% случаев. Отсутствуют данные о влиянии препарата Зоэли® на риск развития венозных тромбозов и эмболий по сравнению с другими КГК- В эпидемиологических исследованиях установлена связь между применением КГК и повышением риска развития артериальной тромбоэмболии (инфаркт миокарда, транзиторные ишемические атаки)- У пациенток, принимавших КГК, исключительно редко развивался тромбоз других сосудов, в том числе печеночных, мезентериальных, почечных, церебральных артерий и вен или сосудов сетчатки. - Симптомы венозных и артериальных тромбозов или острого нарушения мозгового кровообращен
1241 Руб.Чарозетта таб. п.о 75мкг №84

Показания Контрацепция. Противопоказания Противопоказания Не следует принимать контрацептивы, содержащие только гестагены, при наличии хотя бы одного из указанных ниже состояний. При его появлении впервые во время приема препарата Чарозетта, следует немедленно прекратить прием препарата. - Повышенная чувствительность к активному веществу или любому вспомогательному веществу препарата: - установленная или предполагаемая беременность: - наличие в данный момент или в анамнезе венозной тромбоэмболии (в т.ч. тромбоз глубоких вен голени, тромбоэмболия легочной артерии): - наличие в данный момент или в анамнезе тяжелого заболевания печени (до тех пор, пока показатели функции печени не нормализуются): - печеночная недостаточность, в т.ч. в анамнезе: - установленные или предполагаемые злокачественные гормонозависимые опухоли: - кровотечение из влагалища неясной этиологии: - непереносимость лактозы, недостаточность лактазы, глюкозо-галактозная мальабсорбция. С осторожностью: При наличии любых из перечисленных ниже состояний/факторов риска следует взвесить пользу от применения гестагена и возможные риски для каждой отдельной женщины. Это следует обсудить с женщиной еще до того, как она решит начать прием препарата Чарозетта. В случае ухудшения, обострения заболевания или возникновения любого из этих состояний впервые женщине следует обратиться к врачу. Врачу следует принять решение о целесообразности дальнейшего применения препарата Чарозетта. - Устойчивая гипертензия, развивающаяся на фоне приема препарата Чарозетта, или при неэффективности антигипертензивной терапии: - тромбоэмболические нарушения, в том числе в анамнезе: женщина должна быть предупреждена о возможности рецидива: - длительная иммобилизация, связанная с операцией или с заболеванием: - поскольку невозможно исключить биологическое влияние гестагенов на развитие рака печени, следует проводить индивидуальную оценку соотношения пользы и риска при назначении препарата женщинам с раком печени: - хлоазма, особенно у женщин с хлоазмой во время беременности в анамнезе: женщинам с предрасположенностью к хлоазме следует избегать воздействия солнечных лучей или ультрафиолетового излучения во время применения препарата Чарозетта. Беременность Во время беременности применение препарата противопоказано. Результаты доклинических исследований показали, что очень высокие дозы гестагенов могут вызывать маскулинизацию плода женского пола. Широкие эпидемиологические исследования не выявили ни повышенного риска врождённых дефектов развития у детей, матери которых принимали пероральные контрацептивы до беременности, ни тератогенного эффекта при непреднамеренном приеме пероральных контрацептивов в ранний период беременности. Препарат Чарозетта не влияет на количество или качество (концентрации белков, лактозы или жиров) грудного молока. Однако небольшие количества этоногестрела экскретируются с грудным молоком, в результате чего в ребенка может поступить 0,01-0,05 мкг этоногестрела на кг массы тела в сутки (основываясь на потреблении 150 мл/кг/сутки грудного молока). Имеются ограниченные данные длительного наблюдения за детьми, чьи матери начинали принимать препарат Чарозетта в течение 4-8-ой недели после родов. Продолжительность грудного вскармливания составила 7 месяцев, и дети находились под наблюдением до достижения возраста до 1,5 (n=32) или до 2,5 лет (n=14). Оценка роста, физического и психомоторного развития не выявила каких-либо различий с малышами, чьи матери использовали медные внутриматочные спирали. Имеющиеся данные говорят, что препарат Чарозетта можно применять во время лактации. Тем не менее необходимо тщательно наблюдать за развитием и ростом грудного ребенка, чья мать применяет препарат Чарозетта. Применение и дозы Как следует принимать препарат Чарозетта Таблетки следует принимать внутрь в том порядке, который указан на упаковке, каждый день приблизительно в одно и то же время, при необходимости запивая небольшим количеством жидкости. Ежедневно необходимо принимать по одной таблетке в течение 28 дней. Каждую последующую упаковку начинают сразу после завершения предыдущей упаковки. Как следует начинать прием препарата Чарозетта При отсутствии предшествующего применения гормональных контрацептивов [в течение последнего месяца] Приём таблеток следует начинать в 1 день менструального цикла (в 1 день менструального кровотечения). Допускается начинать приём на 2-5 день, но тогда во время первого цикла в течение первых 7 дней приема таблеток рекомендуется дополнительно применять барьерный метод контрацепции. Переход с комбинированного гормонального контрацептива (комбинированного перорального контрацептива, вагинального кольца или трансдермального пластыря)Женщина должна начать прием препарата Чарозетта предпочтительно на следующий день после приема последней активной таблетки комбинированного перорального контрацептива (последняя таблетка, содержащая активное вещество) или в день удаления вагинального кольца или пластыря. В этих случаях отсутствует необходимость в дополнительной контрацепции. Самое позднее женщина может также начать прием препарата Чарозетта на следующий день после окончания обычного интервала в приеме таблеток, пластыря, кольца или на следующий день после приема плацебо таблеток предыдущего комбинированного перорального контрацептива (т.е. в день, когда нужно было бы начать использовать новую упаковку комбинированного перорального контрацептива, ввести новое кольцо или приклеить новый пластырь), но в течение первых 7 дней приема таблеток рекомендуется применять дополнительный барьерный метод контрацепции. Переход с других препаратов, содержащих только гестаген ("мини-пили", инъекции, имплантата или гестагенвысвобождающей внутриматочной системы) Женщина, принимающая "мини-пили", может перейти на прием препарата Чарозетта в любой день. Женщина, использующая имплантат или внутриматочную систему - в день их удаления. Женщина, применяющая инъекционные формы контрацептивов - в день, когда должна быть сделана следующая инъекция. Во всех этих случаях дополнительный метод контрацепции не требуется. После аборта, сделанного в первом триместре После аборта, сделанного в первом триместре, рекомендуется начинать прием препарата немедленно: дополнительный метод контрацепции не требуется. После родов или аборта, сделанного во втором триместре Прием препарата возможен не ранее 21-28 дня после аборта, сделанного во втором триместре, и не ранее 6 недели после родов. При начале приема препарата в более поздние сроки необходимо дополнительно применять барьерный метод контрацепции в течение первых 7 дней приема таблеток. Однако, если у женщины после родов или аборта до начала приема препарата Чарозетта уже были половые контакты, до начала применения препарата следует исключить беременность или женщине необходимо дождаться первой менструации. Для кормящих грудью женщин см. раздел "Применение при беременности и лактации". Как поступать в случае пропуска очередного приема таблеток Контрацептивная защита может снизиться, если интервал между приемом двух таблеток составляет более 36 часов. Если опоздание в приеме таблетки составляет менее 12 часов, то пропущенную таблетку следует принять сразу, как только женщина вспомнит об этом, и следующую таблетку следует принять в обычное время. Если опоздание в приеме таблетки составляет более 12 часов, то женщина должна следовать вышеуказанным рекомендациям, а также применять дополнительный метод контрацепции, в течение следующих 7 дней. Если таблетки были пропущены в самую первую неделю приема препарата и имел место половой акт в течение недели, предшествующей пропуску приема таблеток, следует исключить беременность. Рекомендации в случае желудочно-кишечных расстройств В случае возникновения тяжелых желудочно-кишечных расстройств (рвота, диарея) всасывание может быть неполным и в этом случае следует применять дополнительные методы контрацепции. Если рвота возникла в течение 3-4 часов после приема, то всасывание может быть неполным. В этом случае необходимо руководствоваться рекомендациями, касающимися приема пропущенных таблеток. Побочные эффекты и передозировка Побочные эффекты: В клинических исследованиях препарата Чарозетта в качестве побочных эффектов чаще всего были отмечены (>:2,5%): нерегулярные кровянистые выделения, акне, изменение настроения, болезненность молочных желез, тошнота и увеличение массы тела. Нежелательные эффекты, представленные ниже в таблице, были оценены исследователями как имеющие установленную, вероятную и возможную связь с приемом препарата.ТАБЛИЦЪУ женщин, применявших (комбинированные) пероральные контрацептивы, наблюдались различные (серьезные) нежелательные эффекты. Они включают венозные и артериальные тромбозы и тромбоэмболии, гормонозависимые опухоли (например, рак молочной железы) и хлоазму. Достоверная связь с приемом гестагенов не установлена: желтуха и/или зуд кожи, связанные с холестазом: образование желчных камней: порфирия: системная красная волчанка: гемолитико-уремический синдром: хорея Сиденхема: герпес беременных: потеря слуха, связанная с отосклерозом: (наследственный) ангионевротический отек. Передозировка: Не сообщалось о серьезных побочных эффектах в результате передозировки. В этом случае могут возникнуть следующие симптомы: тошнота, рвота и у молодых девушек - незначительное вагинальное кровотечение. Антидотов не существует и дальнейшее лечение должно быть симптоматическим. Взаимодействие с другими ЛС: Взаимодействие между пероральными контрацептивами и другими лекарственными препаратами может приводить к прорывному кровотечению и/или к снижению контрацептивной эффективности. В литературе сообщается о следующих взаимодействиях (в основном с комбинированными контрацептивами, но иногда также сообщается и в отношении гестагенсодержащих контрацептивов). Печеночный метаболизм: могут возникать взаимодействия с лекарственными препаратами, индуцирующими микросомальные ферменты, что приводит к увеличению клиренса половых гормонов (например, гидантоины (например, фенитоин), барбитураты (например, фенобарбитал), примидон, карбамазепин, рифампицин: и, вероятно, также и окскарбазепин, рифабутин, топирамат, фелбамат, ритонавир, нелфинавир, гризеофульвин и препараты, содержащие зверобой продырявленный (Hypericum perforatum)). Женщинам, применяющим любое из этих лекарств, следует временно использовать барьерный метод в дополнение к препарату Чарозетта или выбрать другой метод контрацепции. Барьерный метод контрацепции следует применять во время применения указанных лекарств и в течение 28 дней после прекращения их приема. Для женщин, получающих длительное лечение индукторами печеночных ферментов, следует рассмотреть возможность использования негормонального метода контрацепции. При применении активированного угля всасывание дезогестрела, находящегося в таблетке, может снизиться и, следовательно, может снизиться контрацептивная эффективность. В таком случае следует поступать в соответствии с рекомендациями относительно пропущенных для приема таблеток. Гормональные контрацептивы могут влиять на метаболизм других лекарств. Соответственно, концентрации лекарственного средства в плазме и в тканях могут как увеличиваться (например, циклоспорин), так и уменьшаться. Примечание: Для выявления возможных взаимодействий следует ознакомиться с инструкцией по применению этих лекарственных средств. Фармакологическое действие и фармакокинетика Чарозетта - это гестагенсодержащий пероральный контрацептив, содержащий гестаген дезогестрел. Подобно другим гестагенсодержащим пероральным контрацептивам ("мини-пили") Чарозетта лучше всего подходит для применения во время кормления грудью и для женщин, которым противопоказаны или которые не хотят принимать эстрогены. В отличие от "мини-пили" контрацептивный эффект препарата Чарозетта достигается в основном за счет подавления овуляции. Другие эффекты включают увеличение вязкости цервикальной слизи. При применении препарата Чарозетта в первые 56 дней частота овуляции не превышает 1%, после прекращения 56-дневного приема препарата овуляция происходит через 7-30 дней (в среднем через 17 дней). В сравнительном исследовании эффективности (в котором допускалось принимать пропущенные таблетки максимум в течение 3 часов) общий индекс Перля (показатель, отражающий частоту наступления беременности у 100 женщин в течение года использования контрацептива) препарата Чарозетта составил 0,4 в группе всех включенных в исследование пациентов. Индекс Перля препарата Чарозетта сравним с индексом Перля комбинированных пероральных контрацептивов в общей популяции принимающих пероральные контрацептивы. Прием препарата Чарозетта приводит к снижению уровня эстрадиола в сыворотке до значений, характерных ранней фолликулярной фазе. При этом не выявлено клинически значимых изменений со стороны углеводного, липидного обмена и показателей гемостаза. Фармакокинетика: Всасывание После приема препарата Чарозетта внутрь дезогестрел быстро всасывается и превращается в биологически активный метаболит этоногестрел. При достижении равновесных состояний пиковые концентрации этоногестрела в сыворотке достигаются через 1,8 часов после приема таблетки внутрь, и абсолютная биодоступность этоногестрела составляет приблизительно 70%. Распределение Этоногестрел на 95,5-99% связан с белками сыворотки, преимущественно с альбумином и в меньшей степени с глобулином, связывающим половые гормоны. Метаболизм Дезогестрел превращается путем гидроксилирования и дегидрогенизации в активный метаболит этоногестрел. Этоногестрел метаболизируется через образование сульфатных и глюкуронидных конъюгатов. Выведение Этоногестрел элиминируется с периодом полувыведения около 30 часов, как при однократном, так и при многократном приеме. Равновесные концентрации в плазме достигаются через 4-5 дней. Клиренс сыворотки при внутривенном введении этоногестрела составляет приблизительно 10 л/ч. Выведение этоногестрела и его метаболитов осуществляется как в форме свободных стероидов, так и в виде конъюгатов почками и кишечником (в соотношении 1,5:1). У женщин, кормящих грудью, этоногестрел экскретируется с грудным молоком в соотношении молоко/сыворотка крови 0,37-0,55. Поэтому при примерном потреблении грудного молока 150 мл/кг/сутки новорожденный может получить 0,01-0,05 мкг этоногестрела на кг массы тела в сутки. Особые указания Медицинские обследования/консультации Перед назначением препарата следует тщательно собрать анамнез у женщины и провести тщательное гинекологическое обследование для исключения беременности. Перед назначением препарата следует установить причину нарушений менструального цикла, например, олигоменореи и аменореи. Интервал между контрольными медицинскими осмотрами определяется врачом в каждом индивидуальном случае (периодичность осмотров - не менее 1 раза в год). Если назначаемый препарат может повлиять на латентное или существующее заболевание, следует составить соответствующий график контрольных медицинских осмотров. Несмотря на регулярный прием препарата Чарозетта, иногда могут возникать нерегулярные кровянистые выделения. Если кровотечения очень частые и нерегулярные, следует рассмотреть возможность применения другого метода контрацепции. Если указанные выше симптомы являются устойчивыми, то в этом случае необходимо исключить органическую патологию. Тактика по отношению к аменорее во время применения препарата зависит от того, принимались ли таблетки в соответствии с инструкцией, и может включать проведение теста на беременность. В случае беременности прием препарата следует прекратить. В случае возникновения острых или хронических нарушений функции печени женщина должна обратиться к специалисту для проведения обследования и консультации. Женщины должны быть информированы о том, что Чарозетта не защищает от ВИЧ-инфекции (СПИДа) и от других заболеваний, передающихся половым путем. Снижение эффективности Эффективность гестагенсодержащих пероральных контрацептивов может быть снижена в случае пропуска приема таблеток, желудочно-кишечных расстройств или при приеме других лекарств. Изменения характера менструаций Во время применения гестагенсодержащих контрацептивов у некоторых женщин вагинальные кровотечения могут стать более частыми или более продолжительными, в то время как у других женщин эти кровотечения могут стать более редкими или вообще прекратиться. Эти изменения часто бывают причиной того, что женщина отказывается от этого метода контрацепции, или перестает строго соблюдать указания врача. При подробной консультации с женщинами, решившими начать прием препарата Чарозетта, врачу следует обсудить возможность таких изменений в характере менструального цикла. Оценка вагинальных кровотечений должна проводиться на основании клинической картины и может включать обследование с целью исключения злокачественных новообразований или беременности. Развитие фолликулов При приеме всех низкодозированных гормональных контрацептивов происходит развитие фолликулов, изредка размер фолликула может достигать размеров, превышающих таковые в нормальном цикле. В общем, эти увеличенные фолликулы исчезают спонтанно. Часто это протекает без симптомов: в некоторых случаях отмечается легкая боль внизу живота. Хирургическое вмешательство требуется редко. Лабораторные анализы Данные, полученные в отношении комбинированных пероральных контрацептивов, показали, что применение гормональных контрацептивов может оказывать влияние на результаты некоторых лабораторных анализов, включая биохимические показатели функции печени, щитовидной железы, надпочечников и почек, на уровни (транспортных) белков в сыворотке, например, на глобулин, связывающий кортикостероиды, на фракции липидов/липопротеинов, показатели углеводного обмена и показатели свертываемости крови и фибринолиза. Обычно эти изменения остаются в пределах нормальных значений. Неизвестно, в какой степени это также применимо и к контрацептивам, содержащим только гестаген. Рак молочной железы Риск рака молочной железы увеличивается с возрастом. Во время применения комбинированных пероральных контрацептивов риск того, что у женщины будет диагностирован рак молочной железы, незначительно увеличивается. Этот повышенный риск постепенно исчезает в течение 10 лет после прекращения применения пероральных контрацептивов, он не связан с продолжительностью применения, а зависит от возраста женщины во время использования комбинированных пероральных контрацептивов. Ожидаемое количество диагностированных случаев рака молочной железы среди 10000 женщин, применявших комбинированные пероральные контрацептивы (в течение 10 лет после прекращения их применения), относительно женщин, которые никогда их не принимали за тот же период, рассчитанное для соответствующих возрастных групп, представлено ниже в таблице.ТАБЛИЦЪ Риск у женщин, применяющих пероральные контрацептивы, содержащие только гестаген, например, препарат Чарозетта, возможно аналогичен таковому при использовании комбинированных пероральных контрацептивов. Однако данные для пероральных контрацептивов, содержащих только гестаген, не столь определенные. По сравнению с риском возникновения рака молочной железы на протяжении всей жизни увеличение риска, связанного с приемом комбинированных пероральных контрацептивов, является небольшим. Рак молочной железы, диагностируемый у женщин, применяющих комбинированные пероральные контрацептивы, имеет тенденцию быть менее клинически развитыми, чем рак, диагностируемый у женщин, которые никогда не применяли комбинированные пероральные контрацептивы. Повышенный риск у женщин, применяющих комбинированные пероральные контрацептивы, возможно, обусловлен более ранней диагностикой, биологическими эффектами препарата или комбинацией этих двух факторов. Венозная тромбоэмболияВ эпидемиологических исследованиях установлена связь между применением комбинированных пероральных контрацептивов и повышенной частотой возникновения венозных тромбоэмболий (ВТЭ, тромбоз глубоких вен и эмболия легочной артерии). И хотя клиническое значение этих данных для дезогестрела как контрацептива, не содержащего эстрогенного компонента, неизвестно, применение препарата Чарозетта следует отменить в случае развития тромбоза. Следует рассмотреть возможность отмены приема препарата Чарозетта в случае длительной иммобилизации, связанной с операцией или заболеванием. Сахарный диабет. Хотя гестагены могут влиять на резистентность периферических тканей к инсулину и на толерантность к глюкозе, нет подтверждения того, что существует необходимость изменять терапевтическую схему у больных сахарным диабетом, применяющих гестагенсодержащие пероральные контрацептивы. Однако женщины, больные сахарным диабетом, должны находиться под тщательным наблюдением в течение первых месяцев применения препарата. Минеральная плотность костной ткани. Применение препарата Чарозетта ведет к снижению уровня эстрадиола в сыворотке до уровня, соответствующего ранней фолликулярной фазе. До настоящего времени неизвестно, оказывает ли это снижение какое-либо клинически значимое влияние на минеральную плотность костной ткани. Предупреждение эктопической беременности. Предупреждение эктопической беременности традиционными гестагенсодержащими пероральными контрацептивами ("мини-пили") не столь эффективно как при комбинированных пероральных контрацептивах, поскольку при применении "мини-пили" часто происходит овуляция. Несмотря на то, что Чарозетта эффективно подавляет овуляцию, в случае аменореи или болей в животе следует исключить внематочную беременность при проведении дифференциальной диагностики. Препарат Чарозетта содержит не более 65 мг лактозы, поэтому женщины, имеющие редкие наследственные нарушения, связанными с непереносимостью галактозы, недостаточностью лактазы Лаппа, или глюкозо-галактозной мальабсорбцией, должны воздержаться от приема препарата. Влияние на способность управлять транспортными средствами: Исходя из фармакодинамического профиля, считается, что препарат Чарозетта не оказывает влияние на способность управлять транспортными средствами и работать с механизмами. Условия хранения и отпуска из аптек Условия хранения:В сухом, защищенном от света месте, при температуре 2-30 °С. Хранить в недоступном для детей месте. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Чарозетта Международное непатентованное название:Дезогестрел. Форма выпуска:таблетки, покрытые пленочной оболочкой. Состав:1 таблетка содержит: активное вещество: дезогестрел 0,075 мг: вспомогательные вещества: крахмал кукурузный 6,5 мг, повидон 1,95 мг, альфа-токоферол 0,08 мг, стеариновая кислота 0,65 мг, кремния диоксид коллоидный 0,65 мг, лактозы моногидрат до 65 мг: оболочка пленочная: Опадрай OY-S-28833 (гипромеллоза 0,75 мг, макрогол-400 0,15 мг, титана диоксид 0,11 мг, тальк 0,19 мг) 1,2 мг. АТХ: Регистрация: Лекарственное средство П N014276/01 Фармгруппа: гестаген. Дата регистрации: 11.08.2008. Окончание регстрации: . Описание:Белые, круглые, двояковыпуклые, покрытые пленочной оболочкой таблетки, с гравировкой "KV" над цифрой "2" на одной стороне таблетки и "ORGANON" с изображением пятиконечной звезды на другой стороне таблетки, на изломе - белого цвета. Упаковка:Таблетки, покрытые пленочной оболочкой, 75 мкг. По 28 таблеток покрытых пленочной оболочкой в блистер из поливинилхлоридной пленки и алюминиевой фольги. Каждый блистер в герметично запаянный саше из ламинированной алюминиевой фольги. По 1, 3 или 6 саше вместе с инструкцией по применению в картонную пачку. Срок годности:3 года. Не использовать после истечения срока годности. Владелец рег.удостоверения:Органон, Н.В. Производитель:ORGANON, N.V. Представительство:МСД Фармасьютикалс ООО
3841 Руб.Метформин Лонг таб. с пролонг. высв. 1000мг №60

Показания Сахарный диабет 2 типа у взрослых, особенно у пациентов с ожирением, при неэффективности диетотерапии и физических нагрузок- в качестве монотерапии- в сочетании с другими пероральными гипогликемическими средствами или инсулином. Противопоказания Противопоказания - повышенная чувствительность к метформину или к любому вспомогательному веществу- диабетический кетоацидоз, диабетическая прекома, кома- почечная недостаточность (клиренс креатинина менее 45 мл/мин)- острые состояния, протекающие с риском развития нарушения функции почек: дегидратация (при хронической или тяжелой диарее, многократных приступах рвоты), тяжелые инфекционные заболевания (например, инфекции дыхательных путей, инфекции мочевыводящих путей), шок- клинически выраженные проявления острых или хронических заболеваний, которые могут приводить к развитию тканевой гипоксии (в том числе, сердечная или дыхательная недостаточность, острый инфаркт миокарда)- обширные хирургические операции и травмы, когда показано проведение инсулинотера-пии (см. раздел "Особые указания")- печеночная недостаточность, нарушение функции печени- хронический алкоголизм, острое отравление алкоголем- беременность- лактоацидоз (в том числе в анамнезе)- применение в течение менее 48 ч до и в течение 48 ч после проведения радиоизотопных или рентгенологических исследований с введением йодсодержащего контрастного вещества (например, внутривенная урография, ангиография) (см. раздел "Взаимодействие с другими лекарственными средствами")- соблюдение гипокалорийной диеты (менее 1000 ккал/сут)- непереносимость лактозы, дефицит лактазы, глюкозо-галактозная мальабсорбция- детский возраст до 18 лет в связи с отсутствием клинических данных о применении. С осторожностью: С осторожностью применять препарат- у лиц старше 60 лет, выполняющих тяжелую физическую работу, что связано с повышенным риском развития у них лактоацидоза- у пациентов с почечной недостаточностью (клиренс креатинина 45 - 59 мл/мин)- в период грудного вскармливания. Беременность Декомпенсировапный сахарный диабет во время беременности связан с повышенным риском возникновения врожденных пороков и перинатальной смертности. Ограниченное количество данных свидетельствует о том, что прием метформина у беременных женщин не увеличивает риск развития врожденных пороков у детей. При планировании беременности, а также в случае наступления беременности на фоне приема метформина, препарат должен быть отменен и назначена инсулинотерапия. Необходимо поддерживать содержание глюкозы в плазме крови на уровне, наиболее близком к норме для снижения риска возникновения пороков развития плода. Метформин проникает в грудное молоко. Побочные эффекты у новорожденных при грудном вскармливании на фоне приема метформина не наблюдались. Однако, в связи с ограниченным количеством данных, применение препарата в период кормления грудью не рекомендовано. Решение о прекращении кормления грудью должно быть принято с учетом пользы от грудного вскармливания и потенциального риска возникновения побочных эффектов у ребенка. Применение и дозы Внутрь. Таблетки проглатывают целиком, не разжевывая, запивая достаточным количеством жидкости, 1 раз в день во время или после ужина. Доза препарата устанавливается врачом индивидуально для каждого пациента на основании результатов измерения концентрации глюкозы в крови. Монотерапия и комбинированная терапия в сочетании с другими гипогликемическими средствами. Рекомендованная доза- для таблеток дозировкой 1000 мг - 1 таблетка (1000 мг) 1 раз в день во время или после ужина. Для таблеток дозировкой 850 мг - 2 таблетки (1700 мг) 1 раз в день. Если при приеме рекомендованной дозы не удается достичь адекватного контроля гликемии, возможно увеличение дозы до максимальной. Максимальная рекомендованная доза- для таблеток дозировкой 850 мг - 3 таблетки 1 раз в день (2550 мг)- для таблеток дозировкой 1000 мг - 2 таблетки 1 раз в день (2000 мг). Если при приеме максимальной рекомендованной дозы один раз в день не удается достичь адекватного контроля гликемии, максимальная доза (для препарата Метформин лонг дозировкой 1000 мг) может быть разделена на два приема: одна таблетка 1000 мг - во время завтрака и одна таблетка 1000 мг - во время ужина. Если адекватный контроль гликемии не достигается и в этом случае, возможен переход на метформин с обычным высвобождением с максимальной суточной дозой 3000 мг. Для пациентов, не принимающих метформин, рекомендуемой начальной дозой метформина пролонгированного действия является доза 500 мг (доступны аналогичные препараты в указанной дозировке) или 850 мг препарата Метформин лонг один раз в сутки во время ужина. Через каждые 10-15 дней рекомендуется корректировать дозу на основании результатов измерения концентрации глюкозы в крови. Медленное увеличение дозы способствует лучшей переносимости со стороны желудочно-кишечного тракта.В случае перехода с другого гипогликемического средства подбор дозы осуществляют, как описано выше, начиная с назначения метформина пролонгированного действия в дозе 500 мг (доступны аналогичные препараты в указанной дозировке) или 850 мг препарата Метформин лонг с возможным последующим переходом на препарат Метформин лонг дозировкой 1000 мг. Препарат Мезформин лонг назначают в качестве поддерживающей терапии пациентам, принимающим метформин в форме таблеток с обычным высвобождением в дозе 1000 мг или 2000 мг. Для перехода на препарат с пролонгированным действием суточная доза должна быть эквивалентна суточной дозе метформина с обычным высвобождением. Пациентам, принимающим метформин в форме таблеток с обычным высвобождением в дозе, превышающей 2000 мг, не рекомендован переход на препарат Метформин лонг. Комбинация с инсулином. Для достижения лучшего гликемического контроля метформин и инсулин можно применять в виде комбинированной терапии. Обычная начальная доза метформина пролонгированного действия составляет 500 мг (доступны аналогичные препараты в указанной дозировке) или 850 мг препарата Метформин лонг один раз в сутки во время ужина, в то время как дозу инсулина подбирают на основании результатов измерения концентрации глюкозы в крови. Далее возможен переход на препарат Метформин лонг дозировкой 1000 мг. Пациенты с почечной недостаточностью Метформин может применяться у пациентов с почечной недостаточностью средней степени тяжести (клиренс креатинина 45 - 59 мл/мин) только в случае отсутствия состояний, которые могут увеличить риск развития лактоацидоза. Начальная доза метформина пролонгированного действия составляет 500 мг (доступны аналогичные препараты в указанной дозировке) или 850 мг препарата Метформин лонг один раз в сутки. Максимальная доза составляет 1000 мг в сутки. Функция почек должна тщательно контролироваться каждые 3-6 месяцев. Если клиренс креатинина ниже 45 мл/мин, прием препарата должен быть немедленно прекращен. Пожилые пациенты. Пожилым пациентам дозу корректируют на основании оценки функции почек, которую необходимо проводить регулярно (см. "Особые указания"). Продолжительность курса лечения. Препарат Метформин лонг следует принимать ежедневно, без перерыва. В случае прекращения лечения пациент должен сообщить об этом врачу. Пропуск дозыВ случае пропуска приема очередной дозы, пациенту следует принять следующую дозу в обычное время. Не следует принимать двойную дозу препарата Метформин лонг. Побочные эффекты и передозировка Побочные эффекты: Частота побочных эффектов препарата расценивается следующим образом:Очень частые: 1/10 Частые: 1/100, <: 1/10 Нечастые: 1/1000, <: 1/100 Редкие: 1/10 000, <: 1/1000 Очень редкие: <:1/10 000. Со стороны обмена веществ и питания: очень редко - лактоацидоз (см. "Особые указания"). При длительном приеме метформина может наблюдаться снижение всасывания витамина B12. При обнаружении мегалобластной анемии необходимо учитывать возможность такой этиологии. Нарушения со стороны нервной системы: часто - нарушение вкуса (металлический привкус во рту). Нарушения со стороны желудочно-кишечного тракта: очень часто - тошнота, рвота, диарея, боли в животе и отсутствие аппетита. Наиболее часто они возникают в начальный период лечения и в большинстве случаев спонтанно проходят. Для предотвращения симптомов рекомендуется принимать метформин во время или после приема пищи. Медленное увеличение дозы может улучшить желудочно-кишечную переносимость. Нарушения со стороны печени и желчевыводящих путей: очень редко: нарушение функции печени и гепатит: после отмены метформина эти нежелательные явления полностью исчезают. Нарушения со стороны кожи и подкожных тканей: очень редко - кожные реакции, такие как эритема (покраснение кожи), зуд, сыпь. Если любые из указанных в инструкции по применению препарата побочных эффектов усугубляются или были замечены другие побочные эффекты, не указанные в инструкции, необходимо сообщить об этом врачу. Передозировка: При применении метформина в дозе 85 г (в 42,5 раз превышающей максимальную суточную дозу) развития гипогликемии не наблюдалось. Однако в этом случае наблюдалось развитие лактоацидоза. Значительная передозировка или сопряженные факторы риска могут привести к развитию лактоацидоза (см. "Особые указания"). Лечение: в случае появления признаков лактоацидоза лечение npenaратом необходимо немедленно прекратить, пациента срочно госпитализировать и, определив- содержание лактата, уточнить диагноз. Наиболее эффективным мероприятием по выведению из организма лактата и метформина является гемодиализ. Проводят также симптоматическое лечение. Взаимодействие с другими ЛС: Противопоказанные комбинации. Йодсодержащие ренгеноконтрастные средства: на фоне функциональной почечной недостаточности у пациентов с сахарным диабетом радиологическое исследование с применением йодсодержащих рентгеноконтрастных средств может вызвать развитие лактоацидоза. Лечение препаратом Метформин лонг необходимо отменить в зависимости от функции почек за 48 часов до или на время рентгенологического исследования с применением йодсодержащих рентгеноконтрастных средств и возобновлять не ранее 48 часов после, при условии, что в ходе обследования почечная функция была признана нормальной. Нерекомендуемые комбинации. Алкоголь: при острой алкогольной интоксикации увеличивается риск развития лактоацидоза, особенно в случае- недостаточного питания, соблюдения низкокалорийной диеты- печеночной недостаточности. Во время приема препарата следует избегать приема алкоголя и лекарственных средств, содержащих этанол. Комбинации, требующие осторожности. Лекарственные средства с непрямым гипергликемическим действием (например, глюкокортикостероиды и тетракозактид (системного и местного действия), β 2 -адреномиметики, даназол, хлорпромазин при приеме в больших дозах (100 мг в день) и диуретики: может потребоваться более частый контроль концентрации глюкозы в крови, особенно в начале лечения. При необходимости доза препарата Метформин лонг может быть скорректирована в процессе лечения и после его прекращения, исходя из уровня гликемии. Диуретики: одновременный прием "петлевых" диуретиков может привести к развитию лактоацидоза из-за возможной функциональной почечной недостаточности. Не следует назначать Метформин лонг, если клиренс креатинина ниже 60 мл/мин. При одновременном применении препарата Метформин лонг с производными сульфонилмочевины, инсулином, акарбозой, салицилатами возможно развитие гипогликемии. Нифедипии повышает абсорбцию и максимальную концентрацию метформина. Катионные лекарственные средства (амилорид, дигоксин, морфии, прокаинамид, хинидин, хинин, ранитидин, триамтерен, триметоприм и ванкомицин), секретирующиеся в почечных канальцах, конкурируют с метформином за канальцевые транспортные системы и могут приводить к увеличению его максимальной концентрации. При совместном применении метформина пролонгированного действия с колесевеламом может увеличиться уровень метформина в крови, при этом может понадобиться регулировка дозы или более жесткий контроль уровня сахара в крови для безопасного применения обоих препаратов. Следует обратиться к врачу при ухудшении состояния или усилении побочных эффектов, таких как тошнота, рвота, диарея, метеоризм, диспепсия. Следует немедленно обратиться к врачу, если развивается слабость, мышечные боли, озноб, повышение сонливости, боль в животе или дискомфорт, медленное или нерегулярное сердцебиение, затрудненное дыхание и другие необычные симптомы, так как они могут быть ранними признаками такого редкого, но серьезного побочного эффекта метформина, как молочнокислый ацидоз. Фармакологическое действие и фармакокинетика Метформин - бигуанид с гипогликемическим действием, снижающий как базальное, так и постпрандиальное содержание глюкозы в плазме крови. Не стимулирует секрецию инсулина и в связи с этим не вызывает гипогликемии. Повышает чувствительность периферических рецепторов к инсулину и утилизацию глюкозы клетками. Снижает выработку глюкозы печенью за счет ингибирования глюконеогенеза и гликогенолиза. Задерживает всасывание глюкозы в кишечнике. Метформин стимулирует синтез гликогена, воздействуя на гликогенсинтазу. Увеличивает транспортную емкость всех типов мембранных переносчиков глюкозы. На фоне приема метформина масса тела пациента либо остается стабильной, либо умеренно снижается. Метформин оказывает благоприятный эффект на метаболизм липидов: снижает содержание общего холестерина, липопротеинов низкой плотности и триглицеридов. Фармакокинетика: Всасывание. Среднее время достижения максимальной концентрации метформина в плазме крови после приема пищи составляет 2,5 часа после однократного приема внутрь 1 таблетки дозировкой 850 мг и 5 часов после однократного приема внутрь 1 таблетки дозировкой 1000 мг (в промежутке 4-10 часов).В равновесном состоянии, идентичном равновесному состоянию метформина с обычным высвобождением, максимальная концентрация и площадь под кривой "концентрация -время" увеличиваются не пропорционально принимаемой дозе. После однократного приема внутрь метформина в форме таблеток пролонгированного действия в дозе 2000 мг площадь под кривой "концентрация - время" аналогична наблюдаемой после приема внутрь метформина в форме таблеток с обычным высвобождением в дозе 1000 мг 2 раза в сутки. Внутрииндивидуальная вариабельность максимальной концентрации и площади под кривой "концентрация - время" после приема метформина в форме таблеток пролонгированного действия аналогична наблюдаемой после приема метформина в форме таблеток с обычным высвобождением. При приеме метформина в форме таблеток пролонгированного действия в дозе 1000 мг после приема пищи площадь под кривой "концентрация - время" увеличивается на 77 % (максимальная концентрация увеличивается на 26 % и среднее время достижения максимальной концентрации метформина в плазме крови увеличивается примерно на 1 час). Всасывание метформина из таблеток пролонгированного действия не изменяется в зависимости от состава принимаемой пищи. Не наблюдается кумуляции при многократном приеме метформина в форме таблеток пролонгированного действия в дозе 2000 мг. Распределение. Связь с белками плазмы незначительна. Максимальная концентрация в крови ниже максимальной концентрации в плазме и достигается примерно через такое же время. Средний объем распределения колеблется в диапазоне 63 - 276 л. Метаболизм. Метаболитов у человека не обнаружено. Выведение. Метформин выводится в неизмененном виде почками. Почечный клиренс метформина составляет более 400 мл/мин. что указывает на то, что метформин выводится за счет клубочковой фильтрации и канальцевой секреции. После перорального приема период полувыведения составляет около 6,5 часов. При нарушенной функции почек клиренс метформина снижается пропорционально клиренсу креатинина, увеличивается период полувыведения, что может приводить к увеличению концентрации метформина в плазме. Особые указания Лактоацидоз. Лактоацидоз является редким, но серьезным (высокая смертность при отсутствии неотложного лечения) осложнением, которое может возникнуть из-за кумуляции метформина. Случаи лактоацидоза при приеме метформина возникали в основном у пациентов с сахарным диабетом с выраженной почечной недостаточностью. Следует учитывать и другие сопряженные факторы риска, такие как декомпенсированный сахарный диабет, кетоз, продолжительное голодание, алкоголизм, печеночная недостаточность и любое состояние, связанное с выраженной гипоксией. Это может помочь снизить частоту случаев возникновения лактоацидоза. Следует учитывать риск развития лактоацидоза при появлении неспецифических признаков, таки как мышечные судороги, сопровождающиеся диспепсическими расстройствами, болью в животе и выраженной астенией. Лакгоацидоз характеризуется сильным недомоганием с общей слабостью, ацидотической одышкой, рвотой, болью в животе, мышечными судорогами и гипотермией с последующей комой. Диагностическими лабораторными показателями являются снижение pH крови (менее 7,25), концентрация лактата в плазме крови свыше 5 ммоль/л, повышенные анионный промежуток и отношение лактат/пируват. При подозрении на лактоацидоз необходимо прекратить прием препарата и немедленно обратиться к врачу. Хирургические операции. Применение метформина должно быть прекращено за 48 часов до проведения плановых хирургических операций и может быть продолжено не ранее чем через 48 часов после, при условии, что в ходе обследования функции почек была признана нормальной. Функция почек. Поскольку метформин выводится почками, перед началом лечения и регулярно в последующем, необходимо определять клиренс креатинина: не реже одного раза в год у пациентов с нормальной функцией ночек и 2 - 4 раза в год у пожилых пациентов, а также у пациентов с клиренсом креатинина на нижней границе нормы. Следует проявлять особую осторожность при возможном нарушении функций почек у пожилых пациентов, при одновременном применении антигипертензивных препаратов, диретиков или нестероидных противовоспалительных препаратов. Другие меры предосторожности- Пациентам рекомендуется продолжать соблюдать диету с равномерным потреблением углеводов в течение дня. Пациентам с избыточной массой тела рекомендуется продолжать соблюдать гипокалорийную диету (но не менее 1000 ккал/сут). Также пациентам следует регулярно делать физические упражнения- Пациенты должны информировать врача о каком-либо проводимом лечении и любых инфекционных заболеваниях, таких как простуда, инфекции дыхательных путей или инфекции мочевыводящих путей- Рекомендуется регулярно проводить стандартные лабораторные анализы для контроля сахарного диабета- Метформин при монотерапии не вызывает гипогликемию, однако рекомендуется проявлять осторожность при его применении в комбинации с инсулином или другими пероральными гипогликемическими средствами (например, производными сульфонилмочеви-ны или репаглинидом и др.). Симптомами гипогликемии являются слабость, головная боль, головокружение, повышенное потоотделение, учащенное сердцебиение, нарушение зрения или нарушение концентрации внимания- Необходимо предупредить пациента, что неактивные компоненты препарата Метформин лонг могут выделяться в неизмененном виде через кишечник, что не влияет на терапевтическую активность препарата. Влияние на способность управлять транспортными средствами: Монотерапия препаратом Метформин лонг не вызывает гипогликемии, поэтому не влияет на способность управлять транспортными средствами и механизмами. Тем не менее, возможно развитие гипогликемии при применении метформина в сочетании с другими гипогликемическими препаратами (производные сульфонилмочевины, инсулин, репаглинид и др.). При появлении симптомов гипогликемии не следует управлять транспортными средствами и механизмами. Условия хранения и отпуска из аптек Условия хранения:В сухом, защищенном от света месте при температуре не выше 25 °С. Хранить в недоступном для детей месте. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Метформин лонг Международное непатентованное название:Метформин. Форма выпуска:Таблетки пролонгированного действия, покрытые пленочной оболочкой. Состав:ТАБЛИЦЪ АТХ: Регистрация: Лекарственное средство ЛП-003855 Фармгруппа: Гипогликемическое средство группы бигуанидов для перорального применения. Дата регистрации: 22.09.2016. Окончание регстрации: . Описание:Таблетки, покрытые пленочной оболочкой, светло-голубого цвета (дозировкой 850 мг) и голубого цвета (дозировкой 1000 мг), продолговатой формы, двояковыпуклые, с риской на одной стороне. На поперечном разрезе видны два слоя: внешний - светло-голубого цвета (для дозировки 850 мг) и голубого цвета (для дозировки 1000 мг), внутренний - белого или почти белого цвета. Упаковка:Таблетки пролонгированного действия, покрытые пленочной оболочкой, 850 мг и 1000 мг. По 10, 30, 60 таблеток в банки полимерные из полиэтилена или полипропилена. По 5, 10, 20 таблеток в контурную ячейковую упаковку из пленки поливинилхлоридной и фольги алюминиевой печатной лакированной или бумаги с полиэтиленовым покрытием. По 1 банке или 2, 6, 12. 20, 24 контурных ячейковых упаковок по 5 таблеток, или 1, 3, 6, 10, 12 контурных ячейковых упаковок по 10 таблеток, или 3, 5, 6 контурных ячейковых упаковок по 20 таблеток вместе с инструкцией по применению помещают в пачку из каргона. Срок годности:2 года. Не применять по истечении срока годности, указанного на упаковке. Владелец рег.удостоверения:БИОСИНТЕЗ, ОАО Производитель:БИОСИНТЕЗ, ОАО. Представительство
533 Руб.Достинекс таб. 0.5мг №8
Показания Предотвращение физиологической лактации после родов- Подавление уже установившейся послеродовой лактации- Лечение нарушений, связанных с гиперпролактинемией, включая аменорею, олигоменорею, ановуляцию, галакторею- Пролактинсекретирующие аденомы гипофиза (микро- и макропролактиномы): идиопатическая гиперпролактинемия: синдром "пустого" турецкого седла в сочетании с гиперпролактинемией. Противопоказания Противопоказания - повышенная чувствительность к каберголину или другим компонентам препарата, а также к любым алкалоидам спорыньи- нарушения функции сердца и дыхания вследствие фиброзных изменений или наличие таких состояний в анамнезе- при длительной терапии: анатомические признаки патологии клапанного аппарата сердца (такие как, утолщение створки клапана, сужение просвета клапана, смешанная патология сужение и стеноз клапана), подтвержденные эхокардиографическим исследованием (ЭхоКГ), проведенным до начала терапии- применение у детей и подростков в возрасте до 16 лет (безопасность и эффективность препарата не установлены)- непереносимость лактозы, дефицит лактазы, глюкозо-галактозная мальабсорбция. С осторожностью: Как и другие производные спорыньи, Достинекс® следует назначать с осторожностью при следующих состояниях и/или заболеваниях- артериальная гипертензия, развившаяся на фоне беременности, например, преэклампсия или послеродовая артериальная гипертензия (Достинекс® назначается только в тех случаях, когда потенциальная польза от применения препарата значительно превышает возможный риск)- тяжелые сердечно-сосудистые заболевания, синдром Рейно- пептическая язва, желудочно-кишечные кровотечения- тяжелая печеночная недостаточность (рекомендуется применение более низких доз)- тяжелые психотические или когнитивные нарушения (в т.ч. в анамнезе)- одновременное применение с препаратами, оказывающими гипотензивное действие (из-за риска развития ортостатической артериальной гипотензии). Беременность Поскольку контролируемых клинических исследований с применением препарата Достинекс® у беременных женщин не проводилось, назначение препарата во время беременности возможно только в случаях крайней необходимости, с учетом соотношения польза/риск для женщины и плода. Если беременность наступила на фоне лечения препаратом Достинекс®, следует рассмотреть целесообразность отмены препарата, также учитывая соотношение польза/риск. По имеющимся данным, применение препарата Достинекс® в дозе 0,5-2 мг в неделю по поводу нарушений, связанных с гиперпролактинемией, не сопровождалось увеличением частоты выкидышей, преждевременных родов, многоплодной беременности и врожденных пороков развития. Сведений о выведении препарата с грудным молоком нет, однако, при отсутствии эффекта применения препарата Достинекс® для предотвращения или подавления лактации матерям следует отказаться от грудного вскармливания. При нарушениях, связанных с гиперпролактинемией, Достинекс® противопоказан пациенткам, планирующим грудное вскармливание. Применение и дозы Внутрь, во время еды. Предотвращение лактации: 1 мг однократно (2 таблетки по 0,5 мг), в первый день после родов. Подавление установившейся лактации: по 0,25 мг (1/2 таблетки) два раза в сутки через каждые 12 часов в течение двух дней (общая доза равна 1 мг). С целью снижения риска ортостатической артериальной гипотензии у кормящих грудью матерей, однократная доза препарата Достинекс® не должна превышать 0,25 мг. Лечение нарушений, связанных с гиперпролактинемией: рекомендуемая начальная доза составляет 0,5 мг в неделю в один прием (1 таблетка 0,5 мг) или в два приема (по 1/2 таблетки 0,5 мг, например, в понедельник и четверг). Повышение недельной дозы должно проводиться постепенно - на 0,5 мг с месячным интервалом до достижения оптимального терапевтического эффекта. Терапевтическая доза обычно составляет 1 мг в неделю, но может колебаться от 0,25 до 2 мг в неделю. Максимальная доза для пациенток с гиперпролактинемией не должна превышать 4,5 мг в неделю. В зависимости от переносимости, недельную дозу можно принимать однократно или разделить на 2 и более приемов в неделю. Разделение недельной дозы на несколько приемов рекомендуется при назначении препарата в дозе более 1 мг в неделю. У пациентов с повышенной чувствительностью к дофаминергическим препаратам вероятность развития побочных явлений можно уменьшить, начав терапию препаратом Достинекс® в более низкой дозе (например, по 0,25 мг один раз в неделю), с последующим постепенным ее увеличением до достижения терапевтической дозы. Для улучшения переносимости препарата при возникновении выраженных побочных явлений возможно временное снижение дозы с последующим более постепенным ее увеличением (например, увеличение на 0,25 мг в неделю каждые две недели). Побочные эффекты и передозировка Побочные эффекты: В ходе клинических исследований с применением препарата Достинекс® для предотвращения физиологической лактации (1 мг однократно) и для подавления лактации (по 0,25 мг каждые 12 часов в течение 2 дней) побочные действия отмечались приблизительно у 14 % женщин. При применении препарата Достинекс® в течение 6 месяцев в дозе 1-2 мг в неделю, разделенной на 2 приема, для лечения нарушений, связанных с гиперпролактинемией, частота побочных явлений составляла 68 %. Побочные явления возникали, в основном, в течение первых 2 недель терапии и в большинстве случаев исчезали по мере продолжения терапии или через несколько дней после отмены препарата Достинекс®. Побочные явления обычно были преходящими, по степени тяжести - слабо или умеренно выражены и носили дозозависимый характер. По крайней мере, однократно в ходе терапии тяжелые побочные явления отмечались у 14 % пациентов: из-за побочных действий лечение было прекращено примерно у 3 % пациентов. Наиболее частые побочные действия представлены ниже: Со стороны сердечно-сосудистой системы: ощущение сердцебиения: при длительном применении Достинекс® обычно оказывает гипотензивное действие, в некоторых случаях может иметь место ортостатическая артериальная гипотензия: возможно бессимптомное снижение АД в течение первых 3-4 дней после родов (систолического - не менее чем на 20 мм рт.ст, диастолического - не менее чем 10 мм рт.ст.). Со стороны нервной системы: головокружение/вертиго, головная боль, повышенная утомляемость, сонливость, депрессия, астения, парестезии, обморок, нервозность, тревога, бессонница, нарушение концентрации внимания. Со стороны пищеварительной системы: тошнота, рвота, боли в эпигастральной области, боль в животе, запор, гастрит, диспепсия, сухость слизистой оболочки полости рта, диарея, метеоризм, зубная боль, ощущение раздражения слизистой оболочки глотки. Прочие: мастодиния, дисменорея, носовое кровотечение, ринит, "приливы" крови к коже лица, транзиторная гемианопсия, спазмы сосудов пальцев и судороги мышц нижних конечностей (как и другие производные спорыньи, Достинекс® может оказывать сосудосуживающее действие), нарушение зрения, гриппоподобные симптомы, недомогание, периорбитальные и периферические отеки, анорексия, акне, кожный зуд, боль в суставах. При длительной терапии с применением препарата Достинекс® отклонение от нормы стандартных лабораторных показателей отмечалось редко: у женщин с аменореей наблюдалось снижение уровня гемоглобина в течение первых нескольких месяцев после восстановления менструации. В постмаркетинговом исследовании зарегистрированы также следующие побочные действия, связанные с приемом каберголина: алопеция, повышение активности креатининфосфокиназы в крови, мании, диспноэ, отеки, фиброз, нарушения функции печени и отклонения показателей функции печени, реакции повышенной чувствительности, сыпь, респираторные нарушения, дыхательная недостаточность, вальвулопатия, патологическое пристрастие к азартным играм, гиперсексуальность, повышенное либидо, агрессивность, психотические расстройства, перикардит, приступы внезапного засыпания, снижение или увеличение массы тела, заложенность носа. Передозировка: Симптомы передозировки (вероятнее, симптомы гиперстимуляции дофаминовых рецепторов): тошнота, рвота, диспептические расстройства, ортостатическая артериальная гипотензия, спутанность сознания, психоз, галлюцинации. При передозировке следует провести вспомогательные мероприятия, направленные на выведение невсосавшегося препарата (промывание желудка) и, при необходимости, поддержание артериального давления. Возможно назначение антагонистов дофамина. Взаимодействие с другими ЛС: Информация о взаимодействии каберголина и других алкалоидов спорыньи отсутствует, поэтому одновременное применение этих лекарственных средств во время длительной терапии препаратом Достинекс® не рекомендуется. Поскольку каберголин оказывает терапевтическое действие путем прямой стимуляции дофаминовых рецепторов, его нельзя назначать одновременно с препаратами, действующими как антагонисты дофамина (фенотиазины, бутирофеноны, тиоксантены, метоклопрамид и др.), т.к. они могут ослабить действие каберголина, направленное на снижение концентрации пролактина. Как и другие производные спорыньи, каберголин нельзя применять одновременно с антибиотиками-макролидами (например, эритромицином), т.к. это может привести к увеличению системной биодоступности каберголина. Фармакологическое действие и фармакокинетика Каберголин является дофаминергическим производным эрголина и характеризуется выраженным и длительным пролактинснижающим действием, обусловленным прямой стимуляцией D2-дофаминовых рецепторов лактотропных клеток гипофиза. Кроме того, при приеме более высоких доз по сравнению с таковыми для снижения концентрации пролактина в плазме крови, каберголин обладает центральным дофаминергическим эффектом вследствие стимуляции D2-рецепторов. Снижение концентрации пролактина в плазме крови отмечается в течение 3 ч после приема препарата и сохраняется в течение 7-28 дней у здоровых добровольцев и пациенток с гиперпролактинемией, и до 14-21 дней - у женщин в послеродовом периоде. Каберголин обладает строго избирательным действием, не оказывает влияния на базальную секрецию других гормонов гипофиза и кортизола. Пролактинснижающее действие каберголина является дозозависимым как в отношении выраженности, так и длительности действия. К фармакодинамическим воздействиям каберголина, не связанным с терапевтическим эффектом, относится только снижение артериального давления (АД). При однократном приеме препарата максимальный гипотензивный эффект отмечается в течение первых 6 часов и является дозозависимым. Фармакокинетика: Каберголин быстро всасывается из желудочно-кишечного тракта, максимальная концентрация в плазме крови достигается через 0,5-4 часа, связь с белками плазмы крови составляет 41-42 %. Период полувыведения каберголина, оцениваемый по скорости выведения почками, составляет 63-68 часов у здоровых добровольцев и 79-115 часов у пациенток с гиперпролактинемией. Вследствие длительного периода полувыведения состояние равновесной концентрации достигается через 4 недели. Через 10 дней после приема каберголина в моче и кале обнаруживаются соответственно около 18 % и 72 % от принятой дозы, причем доля неизмененного каберголина в моче составляет 2 - 3 %. Основным продуктом метаболизма каберголина, идентифицированным в моче, является 6-аллил-8β-карбокси-эрголин в концентрации до 4-6 % от принятой дозы. Содержание в моче 3 дополнительных метаболитов не превышает 3 % от принятой дозы. Установлено, что продукты метаболизма обладают значительно меньшим эффектом в отношении подавления секреции пролактина по сравнению с каберголином. Прием пищи не влияет на всасывание и распределение каберголина. Особые указания Перед назначением препарата Достинекс® с целью лечения нарушений, связанных с гиперпролактинемией, необходимо провести полное исследование функции гипофиза. Кроме того, следует провести оценку состояния сердечно-сосудистой системы, включая ЭхоКГ с целью выявления нарушений функции клапанного аппарата, протекающих бессимптомно. Как и при применении других производных спорыньи, после длительного приема каберголина у пациентов наблюдались плевральный выпот/плевральный фиброз и вальвулопатия. В некоторых случаях пациенты получали предшествующую терапию эрготониновыми агонистами дофамина. Поэтому Достинекс® не следует применять у пациентов с имеющимися признаками и/или клиническими симптомами нарушения функции сердца или дыхания, связанными с фиброзными изменениями или с такими состояниями в анамнезе. Следует отменить прием препарата в случае обнаружения признаков появления или ухудшения регургитации крови, сужения просвета клапанов или утолщения створок клапанов (см. раздел "Противопоказания"). Было установлено, что скорость оседания эритроцитов возрастает при развитии плеврального выпота или фиброза. В случае обнаружения необъяснимого увеличения скорости оседания эритроцитов, рекомендуется выполнить рентгенографическое исследование грудной клетки. В постановке диагноза также может помочь исследование концентрации креатинина в плазме крови, оценка почечной функции. После прекращения приема препарата Достинекс® у пациентов с наличием плеврального выпота/плеврального фиброза или вальвулопатии отмечалось улучшение симптомов. Неизвестно может ли каберголин ухудшать состояние пациентов с признаками регургитации крови. Каберголин не следует применять при выявлении фиброзных поражений клапанного аппарата сердца (см. раздел "Противопоказания"). Фибротические нарушения могут развиваться бессимптомно. В связи с этим следует регулярно контролировать состояние пациентов, получающих длительную терапию каберголином и обращать особое внимание, на следующие симптомы- плевро-легочные нарушения: такие, как одышка, затруднение дыхания, непроходящий кашель или боль в грудной клетке- почечная недостаточность или обструкция сосудов мочеточников или органов брюшной полости, которые могут сопровождаться болью в боку или в области поясницы и отеками нижних конечностей, любые припухлости или болезненность при дотрагивании в области живота, что может свидетельствовать о развитии ретроперитонеального фиброза- перикардиальный фиброз и фиброз створок клапанов сердца часто манифестируют сердечной недостаточностью. В связи с этим необходимо исключить фиброз створок клапанов сердца (и констриктивный перикардит) при появлении симптомов сердечной недостаточности. Следует регулярно проводить мониторинг состояния пациента на предмет развития фибротических нарушений. Первый раз ЭхоКГ должна быть проведена через 3-6 месяцев после начала терапии. Затем данное исследование необходимо проводить в зависимости от клинической оценки состояния пациента, уделяя особое внимание симптомам, описанным выше, как минимум каждые 6-12 месяцев терапии. Необходимость других методов мониторинга (например, физикальное обследование, включая аускультацию сердца, рентгенографию, компьютерную томографию) оценивается индивидуально для каждого пациента. При увеличении дозы пациенты должны находиться под наблюдением врача с целью установления наименьшей эффективной дозы, обеспечивающей терапевтический эффект. После того, как будет подобран эффективный режим дозирования, рекомендуется проводить регулярное (1 раз в месяц) определение концентрации пролактина в сыворотке крови. Нормализация концентрации пролактина обычно наблюдается в течение 2-4 недель лечения. После отмены препарата Достинекс® обычно наблюдается рецидив гиперпролактинемии, однако у некоторых пациенток отмечается стойкое подавление концентрации пролактина в течение нескольких месяцев. У большинства женщин овуляторные циклы сохраняются в течение не менее 6 месяцев после отмены препарата Достинекс®. Достинекс® восстанавливает овуляцию и фертильность у женщин с гиперпролактинемическим гипогонадизмом. Поскольку беременность может наступить до восстановления менструации, рекомендуется проводить тесты на беременность не реже одного раза в 4 недели в течение периода аменореи, а после восстановления менструации -каждый раз, когда отмечается задержка менструации более чем на 3 дня. Женщинам, желающим избежать беременности, следует использовать барьерные методы контрацепции во время лечения препаратом Достинекс®, а также после отмены препарата до повторения ановуляции. Женщины, у которых наступила беременность, должны находиться под наблюдением врача для своевременного выявления симптомов увеличения гипофиза, поскольку во время беременности возможно увеличение размеров уже существовавших опухолей гипофиза. Достинекс® следует назначать в более низких дозах пациентам с тяжелой печеночной недостаточностью (класс С по классификации Чайлд-Пью), которым показана длительная терапия препаратом. При однократном применении таким пациентам дозы 1 мг отмечалось увеличение AUC (площадь под кривой "концентрация-время") по сравнению со здоровыми добровольцами и пациентами с менее выраженной печеночной недостаточностью. Применение каберголина вызывает сонливость. У пациентов с болезнью Паркинсона применение агонистов дофаминовых рецепторов может вызвать внезапное засыпание. В подобных случаях рекомендуется снизить дозу препарата Достинекс® или прекратить терапию. Исследований по применению препарата у пациентов пожилого возраста с нарушениями, связанными с гиперпролактинемией, не проводилось. Безопасность и эффективность препарата у детей младше 16 лет не установлена. Влияние на способность управлять транспортными средствами: Пациенты, принимающие препарат Достинекс®, должны воздержаться от управления транспортными средствами и механизмами и другой потенциально опасной деятельности, требующей концентрации внимания и быстроты психомоторных реакций. Условия хранения и отпуска из аптек Условия хранения:При температуре не выше 25 °С. Хранить в недоступном для детей месте. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Достинекс® Международное непатентованное название:Каберголин. Форма выпуска:Таблетки. Состав:Каждая таблетка содержит:активное вещество: каберголин 0,5 мг:вспомогательные вещества: лактоза 75,9 мг, лейцин 3,6 мг. АТХ: Регистрация: Лекарственное средство П N013905/01 Фармгруппа: Дофаминовых рецепторов агонист. Дата регистрации: 19.11.2007/14.10.2015. Окончание регстрации: . Описание:Белые плоские продолговатые таблетки с маркировкой "Р" и "U", разделенными насечкой с одной стороны и "700" с короткими насечками сверху и снизу числа - с другой стороны. Упаковка:Таблетки 0,5 мг. По 2 или по 8 таблеток во флакон темного стекла типа I, закрытый навинчивающейся алюминиевой крышкой с пластиковой вставкой, содержащей подсушивающий агент и пористую бумагу на дне. 1 флакон с инструкцией по применению в картонной пачке. Срок годности:2 года. Не использовать по истечении срока годности. Владелец рег.удостоверения:Пфайзер Италия С.р.Л. Производитель:PFIZER ITALIA, S.r.L. Представительство:Пфайзер Эйч. Си. Пи. Корпорэйшн
2897 Руб.Ярина таб. п/о №21

Показания Контрацепция. Противопоказания Противопоказания Препарат Ярина® противопоказан при наличии любого из состояний/заболеваний, перечисленных ниже. Если какие-либо из этих состояний/заболеваний развиваются впервые на фоне приема, препарат должен быть немедленно отменен- тромбозы (венозные и артериальные) и тромбоэмболии (в том числе тромбоз глубоких вен, тромбоэмболия легочной артерии, инфаркт миокарда, инсульт), цереброваскулярные нарушения - в настоящее время или в анамнезе- состояния, предшествующие тромбозу (в том числе транзиторные ишемические атаки, стенокардия) в настоящее время или в анамнезе- выявленная приобретенная или наследственная предрасположенность к венозному или артериальному тромбозу, включая резистентность к активированному протеину С, дефицит антитромбина III, дефицит протеина С, дефицит протеина S, гипергомоцистеинемия, антитела к фосфолипидам (антитела к кардиолипину, волчаночный антикоагулянт)- наличие высокого риска венозного или артериального тромбоза (смотри раздел "Особые указания")- мигрень с очаговыми неврологическими симптомами в настоящее время или в анамнезе- сахарный диабет с сосудистыми осложнениями- панкреатит с выраженной гипертриглицеридемией в настоящее время или в анамнезе- печеночная недостаточность и тяжелые заболевания печени (до нормализации печеночных проб)- опухоли печени (доброкачественные или злокачественные) в настоящее время или в анамнезе- тяжелая или острая почечная недостаточность: - выявленные гормонозависимые злокачественные заболевания (в том числе половых органов или молочных желез) или подозрение на них- кровотечение из влагалища неясного генеза- беременность или подозрение на нее- период грудного вскармливания- повышенная чувствительность к любому из компонентов препарата Ярина®: - непереносимость лактозы, дефицит лактазы, глюкозо-галактозная мальабсорбция (в состав препарата входит лактозы моногидрат). С осторожностью: Следует тщательно взвешивать потенциальный риск и ожидаемую пользу применения КОК в каждом индивидуальном случае при наличии следующих заболеваний/состояний и факторов риска- факторы риска развития тромбоза и тромбоэмболий: курение: ожирение: дислипопротеинемия, контролируемая артериальная гипертензия: мигрень без очаговой неврологической симптоматики: пороки клапанов сердца: наследственная предрасположенность к тромбозу (тромбозы, инфаркт миокарда или нарушение мозгового кровообращения в молодом возрасте у кого-либо из ближайших родственников)- другие заболевания, при которых могут отмечаться нарушения периферического кровообращения: сахарный диабет: системная красная волчанка: гемолитико-уремический синдром: болезнь Крона и язвенный колит: серповидно-клеточная анемия: флебит поверхностных вен- наследственный ангионевротический отек- гипертриглицеридемия- заболевания печени, не относящиеся к противопоказаниям (см. "Противопоказания")- заболевания, впервые возникшие или усугубившиеся во время беременности или на фоне предыдущего приема половых гормонов (например, желтуха и/или зуд, связанные с холестазом, холелитиаз, отосклероз с ухудшением слуха, порфирия, герпес во время беременности, хорея Сиденгама): - послеродовый период. Беременность Препарат Ярина® противопоказан во время беременности и в период грудного вскармливания. Если беременность выявляется во время приема препарата Ярина®, препарат следует сразу же отменить. Обширные эпидемиологические исследования не выявили повышенного риска дефектов развития у детей, рожденных женщинами, получавшими половые гормоны до беременности или тератогенного действия в случаях приема половых гормонов по неосторожности в ранние сроки беременности. В то же время имеющиеся данные о применении препарата Ярина® во время беременности ограничены, что не позволяет сделать какие-либо выводы о негативном влиянии препарата на беременность, здоровье плода и новорожденного ребенка. В настоящее время какие-либо значимые эпидемиологические данные отсутствуют. Прием препарата может уменьшать количество грудного молока и изменять его состав, поэтому применение препарата противопоказано до прекращения грудного вскармливания. Небольшое количество половых гормонов и/или их метаболитов может проникать в грудное молоко и оказывать влияние на здоровье ребенка. Применение и дозы Как и когда принимать таблетки Календарная упаковка препарата Ярина® содержит 21 таблетку. Каждая таблетка в упаковке маркируется днем недели, в который она должна быть принята. Таблетки следует принимать внутрь каждый день в течение 21 дня по порядку, указанному на упаковке, примерно в одно и то же время, запивая небольшим количеством воды. Прием таблеток из следующей упаковки начинается после 7-дневного перерыва, во время которого обычно развивается менструальноподобное кровотечение (кровотечение "отмены"). Как правило, оно начинается на 2-3 день после приема последней таблетки и может не закончиться до начала приема таблеток из новой упаковки. После 7-дневного перерыва начать прием таблеток из новой упаковки необходимо даже в случае, если менструальноподобное кровотечение еще не прекратилось. Это означает, что начинать прием таблеток из новой упаковки необходимо в один и тот же день недели, и что каждый месяц кровотечение "отмены" будет наступать примерно в один и тот же день недели. Прием таблеток из первой упаковки препарата Ярина® - Когда никакое гормональное противозачаточное средство не применялось в предыдущем месяце Прием препарата Ярина® следует начать в первый день менструального цикла (т.е. в первый день менструального кровотечения). Необходимо принять таблетку, которая промаркирована соответствующим днем недели. Затем следует принимать таблетки по порядку. Допускается начать прием препарата на 2-5 день менструального цикла, но в этом случае в течение первых 7 дней приема таблеток из первой упаковки рекомендуется дополнительно использовать барьерный метод контрацепции. - При переходе с других комбинированных контрацептивных препаратов (КОК, вагинального кольца или трансдермального пластыря) Предпочтительно начать прием препарата Ярина® на следующий день после приема последней активной таблетки из предыдущей упаковки, но ни в коем случае не позднее следующего дня после обычного 7-дневного перерыва (для препаратов, содержащих 21 таблетку) или после приема последней неактивной таблетки (для препаратов, содержащих 28 таблеток в упаковке). Прием препарата Ярина® следует начинать в день удаления вагинального кольца или пластыря, но не позднее дня, когда должно быть введено новое кольцо или наклеен новый пластырь. - При переходе с контрацептивов, содержащих только гестагены ("мини-пили", инъекционные формы, имплантат) или с внутриматочной терапевтической системы с высвобождением гестагена Перейти с "мини-пили" на препарат Ярина® можно в любой день (без перерыва), с имплантата или внутри маточного контрацептива с гестагеном - в день их удаления, с инъекционной формы - в день, когда должна быть сделана следующая инъекция. Во всех этих случаях в течение первых 7 дней приема таблеток препарата Ярина® необходимо дополнительно использовать барьерный метод контрацепции (например, презерватив). - После аборта (в том числе самопроизвольного) в первом триместре беременности Начать прием препарата можно немедленно. При соблюдении этого условия дополнительных мер контрацепции не требуется- После родов (при отсутствии грудного вскармливания) или аборта (в том числе самопроизвольного) во втором триместре беременности. Начать прием препарата рекомендуется на 21-28 день после родов (при отсутствии грудного вскармливания) или аборта во втором триместре беременности. Если прием препарата начат позднее, необходимо использовать дополнительно барьерный метод контрацепции в течение первых 7 дней приема таблеток. Если половой контакт имел место до начала приема препарата Ярина®, необходимо исключить беременность. Прием пропущенных таблеток. Если опоздание в приеме препарата составило менее 12 часов, контрацептивная защита не снижается. Нужно принять пропущенную таблетку как можно скорее, следующая таблетка принимается в обычное время. Если опоздание в приеме таблеток составило более 12 часов, контрацептивная защита снижается. Чем больше таблеток пропущено, и чем ближе пропуск к 7-дневному перерыву в приеме таблеток, тем выше вероятность наступления беременности. При этом необходимо помнить- Прием препарата никогда не должен быть прерван более чем на 7 дней- 7 дней непрерывного приема таблеток требуется для достижения адекватного подавления гипоталамо-гипофизарно-яичниковой системы. Соответственно, если опоздание в приеме таблеток превышает 12 часов (интервал с момента приема последней таблетки - более 36 часов), в зависимости от недели, когда пропущена таблетка, необходимо: Первая неделя приема препарата. Необходимо принять последнюю пропущенную таблетку как можно скорее, как только женщина вспомнит об этом (даже если для этого нужно принять две таблетки одновременно). Следующую таблетку необходимо принять в обычное время. В течение последующих 7 дней дополнительно должен быть использован барьерный метод контрацепции (например, презерватив). Если половой контакт имел место в течение 7 дней перед пропуском таблетки, необходимо учесть возможность наступления беременности. Вторая неделя приема препарата. Необходимо принять последнюю пропущенную таблетку как можно скорее, как только женщина вспомнит об этом (даже если для этого нужно принять две таблетки одновременно). Следующую таблетку необходимо принять в обычное время. При условии, если женщина принимала таблетки правильно в течение предшествующих 7 дней, нет необходимости в использовании дополнительных контрацептивных мер. В противном случае, а также при пропуске двух и более таблеток, необходимо дополнительно использовать барьерные методы контрацепции (например, презерватив) в течение последующих 7 дней. Третья неделя приема препарата. Риск снижения контрацептивной надежности неизбежен из-за предстоящего перерыва в приеме таблеток. В этом случае необходимо придерживаться следующих алгоритмов- если в течение 7 дней, предшествующих первой пропущенной таблетке, все таблетки принимались правильно, нет необходимости использовать дополнительные методы контрацепции. При приеме пропущенных таблеток руководствуйтесь пунктами 1 или 2- если в течение 7 дней, предшествующих первой пропущенной таблетке, таблетки принимались неправильно, то в течение последующих 7 дней необходимо дополнительно использовать барьерный метод контрацепции (например, презерватив) и в этом случае следует руководствоваться пунктом 1 для приема пропущенных таблеток.1. Необходимо принять пропущенную таблетку как можно скорее, как только женщина вспомнит об этом (даже если это означает прием двух таблеток одновременно). Следующие таблетки принимают в обычное время, пока не закончатся таблетки из текущей упаковки. Прием таблеток из следующей упаковки следует начать сразу же без обычного 7-дневного перерыва. Кровотечение "отмены" маловероятно, пока не закончатся таблетки из второй упаковки, но могут отмечаться "мажущие" выделения и/или "прорывные" кровотечения в дни приема препарата.2. Можно также прервать прием таблеток из текущей упаковки, сделать перерыв на 7 или менее дней (включай дни пропуска таблеток), после чего начать прием таблеток из новой упаковки. Если женщина пропустила прием таблеток, а во время перерыва в приеме у нее нет кровотечения "отмены", необходимо исключить беременность (см. рис.). Допускается принимать не более двух таблеток в один день. Рекомендации при желудочно-кишечных расстройствах. При тяжелых желудочно-кишечных расстройствах всасывание препарата может быть неполным, поэтому следует использовать дополнительные методы контрацепции. Если в течение 3-4 часов после приема таблеток отмечается рвота или диарея, в зависимости от недели приема препарата следует ориентироваться на рекомендации при пропуске таблеток, указанные выше. Если женщина не хочет менять свою обычную схему приема и переносить начало менструации на другой день недели, дополнительную таблетку следует принять из другой упаковки. Прекращение приема препарата Ярина®Прием препарата Ярина® можно прекратить в любое время. Если женщина не планирует беременность, следует позаботиться о других методах контрацепции. Если планируется беременность, следует просто прекратить прием препарата Ярина® и подождать естественного менструального кровотечения. Отсрочка начала менструальноподобного кровотечения. Для того, чтобы отсрочить начало менструальноподобного кровотечения, необходимо продолжить дальнейший прием таблеток из новой упаковки препарата Ярина® без 7-дневного перерыва. Таблетки из новой упаковки могут приниматься так долго, как это необходимо, в том числе до тех пор, пока таблетки в упаковке не закончатся. На фоне приема препарата из второй упаковки могут отмечаться "мажущие" кровянистые выделения из влагалища и/или "прорывные" маточные кровотечения. Возобновить прием препарата Ярина® из очередной упаковки следует после обычного 7-дневного перерыва. Изменение дня начала менструальноподобного кровотечения. Для того чтобы перенести день начала менструальноподобного кровотечения на другой день недели, женщине следует сократить (но не удлинять) ближайший 7-дневный перерыв в приеме таблеток на столько дней, на сколько женщина хочет. Например, если цикл обычно начинается в пятницу, а в будущем женщина хочет, чтобы он начинался во вторник (3 днями ранее), прием таблеток из следующей упаковки необходимо начать на 3 дня раньше, чем обычно. Чем короче перерыв в приеме таблеток, тем выше вероятность, что менструальноподобное кровотечение не наступит, и во время приема таблеток из второй упаковки будут наблюдаться "мажущие" выделения и/или "прорывные" кровотечения. Применение у отдельных групп пациентокУ детей и подростков. Препарат Ярина® показан только после наступления менархе. Имеющиеся данные не предполагают коррекции дозы у данной группы пациенток.У пожилых. Не применимо. Препарат Ярина® не показан после наступления менопаузы. При нарушениях функции печени. Препарат Ярина® противопоказан к применению у женщин с тяжелыми заболеваниями печени до тех пор, пока показатели функции печени не придут в норму. См. также раздел "Противопоказания" и "Фармакологические свойства". При нарушениях функции почек Препарат Ярина® противопоказан женщинам с тяжелой почечной недостаточностью или с острой почечной недостаточностью. См. также разделы "Противопоказания" и "Фармакологические свойства". Побочные эффекты и передозировка Побочные эффекты: Данные о частоте возникновения побочных реакций, о которых сообщалось в ходе клинических исследований препарата Ярина® (N=4897), приведены в таблице ниже. В пределах каждой группы, выделенной в зависимости от частоты возникновения, побочные реакции представлены в порядке уменьшения их тяжести. По частоте они разделяются на частые (>:1/100 и <:1/10), нечастые (>:1/1000 и <:1/100) и редкие (>:1/10000 и <:1/1000). Для дополнительных побочных реакций, выявленных только в процессе постмаркетинговых исследований, и для которых оценку частоты возникновения провести не представлялось возможным, указано "частота неизвестна". ТАБЛИЦЪ Нежелательные явления в ходе клинических исследований были кодифицированы с использованием словаря MedDRA (Медицинский Словарь Регуляторной Деятельности, версия 12.1). Различные термины MedDRA, отражающие один и тот же симптом, были сгруппированы вместе и представлены в качестве единственной побочной реакции, во избежание ослабления или размытия истинного эффекта. * Расчетная частота по данным эпидемиологических исследований, охватывавших группу КОК. Венозные и артериальные тромбоэмболические осложнения объединяют следующие нозологические формы: окклюзия периферических глубоких вен, тромбоз и тромбоэмболия /окклюзия легочных сосудов, тромбоз, эмболия и инфаркт /инфаркт миокарда/церебральный инфаркт и инсульт не классифицированный как геморрагический. Для венозной и артериальном тромбоэмболии, мигрени см. также "Противопоказания" и "Особые указания". Ниже перечислены побочные реакции с очень низкой частотой возникновения или с отсроченным развитием симптомов, которые считаются связанными с группой КОК (см. также разделы "Противопоказания”, “Особые указания"): Опухоли - У женщин, применяющих КОК, очень незначительно повышена частота выявления рака молочной железы. Поскольку рак молочной железы редко встречается у женщин моложе 40 лет, повышение частоты рака у женщин, применяющих КОК, незначительно по отношению к общему риску возникновения рака молочной железы. Причинно-следственная связь с применением КОК неизвестна. - Опухоли печени (доброкачественные и злокачественные). Прочие состояния - Узловатая эритема. - Женщины с гипертриглицеридемией (повышенный риск панкреатита при применении КОК). - Повышение артериального давления. - Наступление или ухудшение состояний, при которых связь с применением КОК не является неоспоримой: желтуха и/или зуд, связанные с холестазом: образование камней желчного пузыря: порфирия: системная красная волчанка: гемолитико-уремический синдром: хорея Сиденгама: герпес во время беременности: потеря слуха, связанная с отосклерозом. - У женщин с наследственным ангионевротическим отеком экзогенные эстрогены могут вызвать или усилить симптомы ангионевротического отека. - Нарушения функции печени. - Нарушения толерантности к глюкозе или влияние на периферическую инсулинорезистентность. - Болезнь Крона, язвенный колит- Хлоазма- Гиперчувствительность (включая такие симптомы как сыпь, крапивница). Взаимодействие Вследствие взаимодействия других препаратов (индукторов ферментов) с пероральными контрацептивами могут возникать "прорывные" кровотечения и/или снижение контрацептивного эффекта (см. раздел "Взаимодействие с другими лекарственными препаратами"). Передозировка: О серьезных нарушениях при передозировке не сообщалось. На основании суммарного опыта применения КОК симптомы, которые могут отмечаться при передозировке: тошнота, рвота, мажущие кровянистые выделения из влагалища, метроррагия. Специфического антидота нет, следует проводить симптоматическое лечение. Взаимодействие с другими ЛС: Влияние других лекарственных средств на препарат Ярина®Возможно взаимодействие с лекарственными средствами, индуцирующими микросомальные ферменты печени, в результате чего может увеличиваться клиренс половых гормонов, что, в свою очередь, может приводить к "прорывным" маточным кровотечениям и/или снижению контрацептивного эффекта. Женщинам, которые получают лечение такими препаратами в дополнение к препарату Ярина®, рекомендуется использовать барьерный метод контрацепции или выбрать иной негормональный метод контрацепции. Барьерный метод контрацепции следует использовать в течение всего периода приема сопутствующих препаратов, а также в течение 28 дней после их отмены. Если период применения барьерного метода контрацепции заканчивается позже, чем таблетки в упаковке препарата Ярина®, следует начать прием таблеток препарата Ярина® из новой упаковки без перерыва в приеме таблеток- Вещества, увеличивающие клиренс препарата Ярина® (ослабляющие эффективность путем индукции ферментов): фенитоин, барбитураты, примидон, карбамазепин, рифампицин и, возможно, также окскарбазепин, топирамат, фелбамат, гризеофульвин, а также препараты, содержащие зверобой продырявленный- Вещества с различным влиянием на клиренс препарата Ярина®При совместном применении с препаратом Ярина® многие ингибиторы протеаз ВИЧ или вируса гепатита С и ненуклеозидные ингибиторы обратной транскриптазы могут как увеличивать, так и уменьшать концентрацию эстрогенов или прогестинов в плазме крови. В некоторых случаях такое влияние может быть клинически значимо- Вещества, снижающие клиренс КОК (ингибиторы ферментов)Сильные и умеренные ингибиторы CYP3A4, такие как азольные антимикотики (например, итраконазол, вориконазол, флюконазол), верапамил, макролиды (например, кларитромицин, эритромицин), дилтиазем и грейпфрутовый сок могут повышать плазменные концентрации эстрогена или прогестина, или их обоих. Было показано, что эторикоксиб в дозах 60 и 120 мг/сутки при совместном приеме с КОК, содержащими 0,035 мг этинилэстрадиола, повышает концентрацию этинилэстрадиола в плазме крови в 1,4 и 1,6 раза соответственно. Влияние препарата Ярина® на другие лекарственные препаратыКОК могут влиять на метаболизм других препаратов, что приводит к повышению (например, циклоспорин) или снижению (например, ламотриджин) их концентрации в плазме крови и тканях. In vitro дроспиренон способен слабо или умеренно ингибировать ферменты цитохрома Р450 CYP1A1, CYP2C9, CYP2C19 и CYP3A4. На основании исследований взаимодействия in vivo у женщин-добровольцев, принимавших омепразол, симвастатин или мидазолам в качестве маркерных субстратов, можно заключить, что клинически значимое влияние 3 мг дроспиренона на метаболизм лекарственных препаратов, опосредованный ферментами цитохрома Р450, маловероятно. In vitro этинилэстрадиол является обратимым ингибитором CYP2C19, CYP1A1 и CYP1A2, а также необратимым ингибитором CYP3A4/5, CYP2C8 и CYP2J2. В клинических исследованиях назначение гормонального контрацептива, содержащего этинилэстрадиол, не приводило к какому-либо повышению или приводило лишь к слабому повышению концентраций субстратов CYP3A4 в плазме крови (например, мидазолама), в то время как плазменные концентрации субстратов CYP1A2 могут возрастать слабо (например, теофиллин) или умеренно (например, мелатонин и тизанидин). Другие формы взаимодействия У пациенток с ненарушенной функцией почек сочетанное применение дроспиренона и ингибиторов ангиотензинпревращающего фермента или нестероидных противовоспалительных препаратов не оказывает значимого эффекта на концентрацию калия в плазме крови. Тем не менее сочетанное применение препарата Ярина® с антагонистами альдостерона или калийсберегающими диуретиками не изучено. При совместном приеме с данными препаратами концентрацию калия в плазме крови необходимо контролировать в течение первого цикла приема (см. раздел "Особые указания"). Фармакологическое действие и фармакокинетика Препарат Ярина® - низкодозированный монофазный пероральный комбинированный эстроген-гестагенный контрацептивный препарат. Контрацептивный эффект препарата Ярина® осуществляется в основном посредством взаимодополняющих механизмов, к наиболее важным из которых относятся подавление овуляции и повышение вязкости секрета шейки матки, в результате чего она становится непроницаемой для сперматозоидов. При правильном применении препарата Ярина® индекс Перля (показатель, отражающий число беременностей у 100 женщин, применяющих контрацептив в течение года) составляет менее 1. При пропуске таблеток или неправильном применении индекс Перля может возрастать. Повышенный риск венозной тромбоэмболии (ВТЭ), связываемый с применением комбинированных пероральных контрацептивов (КОК), относится, прежде всего, к эстрогенному компоненту. В настоящее время продолжаются научные споры относительно модулирующего эффекта прогестина, входящего в состав КОК, в отношении риска ВТЭ. Сравнительные эпидемиологические исследования риска ВТЭ при применении КОК, содержащих этинилэстрадиол/дроспиренон, и риска при применении левоноргестрел-содержащих КОК показали различные результаты - от отсутствия отличий по степени риска, до трехкратного возрастания риска. В большинстве исследований изучался препарат Ярина®. Для оценки риска ВТЭ при применении препарата Ярина® (этинилэстрадиол/дроспиренон в дозах 0,03 мг/3 мг) были проведены два пострегистрационных исследования. Первое проспективное наблюдательное исследование показало, что частота возникновения ВТЭ у женщин, применяющих препарат Ярина®, при наличии или в отсутствии других факторов риска ВТЭ была в том же диапазоне, что и для женщин, применяющих левоноргестрел-содержащие и другие КОК. Второе проспективное контролируемое исследование баз данных, в ходе которого проводилась сравнительная оценка женщин, применяющих препарат Ярина®, с женщинами, применяющими другие КОК, также подтвердило сходную частоту ВТЭ среди всех когорт женщин.У женщин, принимающих КОК, цикл становится более регулярным, реже наблюдаются болезненные менструальноподобные кровотечения, уменьшается интенсивность и продолжительность кровотечения, в результате чего снижается риск железодефицитной анемии. Также имеются данные о снижении риска рака эндометрия и яичников при приеме КОК. Дроспиренон, входящий в состав препарата Ярина®, обладает атиминералокортикоидной активностью и способен предупреждать увеличение массы тела и появление других симптомов (например, отеков), связанных с эстрогензависимой задержкой жидкости. Дроспиренон также обладает антиандрогенной активностью и способствует уменьшению угрей (акне), жирности кожи и волос (себореи). Эти особенности дроспиренона следует учитывать при выборе контрацептива женщинам с гормонозависимой задержкой жидкости, а также женщинам с акне и себореей. По своим характеристикам дроспиренон схож с естественным прогестероном, вырабатываемым женским организмом. Фармакокинетика: Дроспиренон Абсорбция При приеме внутрь дроспиренон быстро и почти полностью абсорбируется. После однократного приема максимальная концентрация (Сmax) дроспиренона в плазме крови, равная 38 нг/мл, достигается через 1-2 часа. Прием пищи не влияет на биодоступность, которая колеблется в диапазоне от 76 до 85%. Распределение Дроспиренон связывается с альбумином плазмы крови и не связывается с глобулином, связывающим половые гормоны (ГСПГ), или кортикостероид-связывающим глобулином (КСГ). Лишь 3-5% от общей концентрации вещества в плазме крови присутствует в виде свободного гормона, 95-97% вещества неспецифически связываются с альбумином. Индуцированное этинилэстрадиолом повышение ГСПГ не влияет на связывание дроспиренона белками плазмы крови. Средний кажущийся объем распределения составляет 3,7±1,2 л/кг. Метаболизм После перорального приема дроспиренон полностью метаболизируется. Большинство метаболитов в плазме крови представлены кислотными формами дроспиренона. Дроспиренон также является субстратом для окислительного метаболизма, катализируемого изоферментом СYР 3А4. Скорость метаболического клиренса дроспиренона из плазмы крови составляет 1,5±0,2 мл/мин/кг. Выведение Концентрация дроспиренона в плазме крови снижается двухфазно. Вторая, окончательная фаза имеет период полувыведения (T1/2) около 31 часа. В неизмененной форме дроспиренон экскретируется в следовых количествах. Его метаболиты выводятся через желудочно-кишечный тракт и почками в соотношении примерно 1,2:1.4. Период полувыведения метаболитов дроспиренона составляет примерно 40 часов. Равновесная концентрация Концентрация ГСПГ не оказывает влияния на показатели фармакокинетики дроспиренона. При ежедневном применении препарата внутрь концентрация дроспиренона в плазме крови повышается в 2-3 раза, равновесная концентрация достигается через 8 дней приема препарата. При нарушении функции почек Исследования показали, что концентрация дроспиренона в плазме крови женщин с легким нарушением функции почек (клиренс креатинина (КК) - 50-80 мл/мин) при достижении равновесного состояния и у женщин с сохранной функцией почек (КК - более 80 мл/мин) сопоставимы. Тем не менее у женщин с умеренным нарушением функции почек (КК - 30-50 мл/мин) средняя концентрация дроспиренона в плазме крови была на 37% выше, чем у пациенток с сохранной функцией почек. Не отмечено изменения концентрации калия в плазме крови при применении дроспиренона. При нарушении функции печени У женщин с умеренным нарушением функции печени (класс В по шкале Чайлд-Пью) площадь под кривой "концентрация-время" (AUC) сопоставима с соответствующим показателем у здоровых женщин с близкими значениями Сmax в фазе абсорбции и распределения. Т1/2 дроспиренона у больных с умеренным нарушением функции печени оказался в 1,8 раз выше, чем у здоровых добровольцев. У больных с умеренным нарушением функции печени отмечено снижение клиренса дроспиренона приблизительно на 50% по сравнению со здоровыми женщинами, при этом не отмечено различий в концентрации калия в плазме крови в изучаемых группах. При выявлении сахарного диабета и сопутствующем применении спиронолактона (оба состояния расцениваются как факторы, предрасполагающие к развитию гиперкалиемии) повышения концентрации калия в плазме крови не установлено. Таким образом, можно заключить, что переносимость дроспиренона у женщин с легким и умеренным нарушением функции печени хорошая (класс В по шкале Чайлд-Пью). Этническая принадлежность Не установлено влияния этнической принадлежности (исследование проведено на когортах женщин европеоидной расы и японок) на параметры фармакокинетики дроспиренона и этинилэстрадиола. Этинилэстрадиол Абсорбция После приема внутрь этинилэстрадиол быстро и полностью абсорбируется. Сmax - 100 нг/мл достигается в течение 1-2 часов. Во время всасывания и "первого прохождения" через печень этинилэстрадиол метаболизируется, в результате чего его биодоступность при приеме внутрь составляет в среднем около 45% при высокой межиндивидуальной вариабельности - от 20 до 65%. Одновременный прием пищи в отдельных случаях сопровождается снижением биодоступности этинилэстрадиола на 25%. Распределение Этинилэстрадиол неспецифически, но прочно связывается с альбумином плазмы крови (около 98%) и индуцирует повышение концентрации в плазме крови ГСПГ. Предполагаемый объем распределения составляет 5 л/кг. Метаболизм Этинилэстрадиол подвергается значительному первичному метаболизму в кишечнике и печени. Этинилэстрадиол и его окислительные метаболиты первично конъюгированы с глюкуронидами или сульфатом. Скорость метаболического клиренса этинилэстрадиола составляет около 5 мл/мин/кг. Выведение Снижение концентрации этинилэстрадиола в плазме крови носит двухфазный характер: первая фаза характеризуется периодом полувыведения около 1 часа, вторая - 20 часов. Этинилэстрадиол практически не выводится в неизмененном виде. Метаболиты этинилэстрадиола выводятся почками и через кишечник в соотношении 4:6. Период полувыведения метаболитов составляет примерно 24 ч. Равновесная концентрация Равновесное состояние достигается во второй половине цикла приема препарата, когда концентрация этинилэстрадиола в плазме крови повышается на 40-110% по сравнению с применением разовой дозы. Особые указания Если какие-либо из состояний, заболеваний и факторов риска, указанных ниже, имеются в настоящее время, то следует тщательно взвешивать потенциальный риск и ожидаемую пользу применения препарата Ярина® в каждом индивидуальном случае и обсудить его с женщиной до того, как она решит начать прием препарата. В случае утяжеления, усиления или первого проявления любого из этих состояний, заболеваний или факторов риска, женщина должна проконсультироваться со своим врачом, который может принять решение о необходимости отмены препарата. Заболевания сердечно-сосудистой системы. Результаты эпидемиологических исследований указывают на наличие взаимосвязи между применением КОК и повышением частоты развития венозных и артериальных тромбозов и тромбоэмболий (таких как тромбоз глубоких вен, тромбоэмболия легочной артерии, инфаркт миокарда, цереброваскулярные нарушения) при приеме КОК. Данные заболевания отмечаются редко. Риск развития ВТЭ максимален в первый год приема КОК. Повышенный риск присутствует после первоначального применения КОК или возобновления применения одного и того же или другого КОК (после перерыва между приемами препарата в 4 недели и более). Данные крупномасштабного проспективного исследования с участием 3 групп пациенток показывают, что этот повышенный риск присутствует преимущественно в течение первых 3 месяцев. Общий риск ВТЭ у женщин, принимающих низкодозированные КОК (<: 0,05 мг этинилэстрадиола) в два-три раза выше, чем у небеременных пациенток, которые не принимают КОК, тем не менее этот риск остается более низким по сравнению с риском ВТЭ во время беременности и родов.ВТЭ может оказаться жизнеугрожающей или привести к летальному исходу (в 1-2% случаев).ВТЭ, проявляющаяся в виде тромбоза глубоких вен или эмболии легочной артерии, может произойти при применении любых КОК. Крайне редко при применении КОК возникает тромбоз других кровеносных сосудов, например, печеночных, брыжеечных, почечных, мозговых вен и артерий или сосудов сетчатки. Симптомы тромбоза глубоких вен: односторонний отек нижней конечности или отек вдоль вены на нижней конечности, боль или дискомфорт в нижней конечности только в вертикальном положении или при ходьбе, локальное повышение температуры в пораженной нижней конечности, покраснение или изменение окраски кожных покровов на нижней конечности. Симптомы тромбоэмболии легочной артерии: затрудненное или учащенное дыхание: внезапный кашель, в том числе с кровохарканием: острая боль в грудной клетке, которая может усиливаться при глубоком вдохе: чувство тревоги: сильное головокружение: учащенное или нерегулярное сердцебиение. Некоторые из этих симптомов (например, одышка, кашель) являются неспецифическими и могут быть истолкованы неверно как признаки других более или менее тяжелых состояний/заболеваний (например, инфекции дыхательных путей). Артериальная тромбоэмболия может привести к инсульту, окклюзии сосудов или инфаркту миокарда. Симптомы инсульта: внезапная слабость или потеря чувствительности лица, конечностей, особенно с одной стороны тела, внезапная спутанность сознания, проблемы с речью и пониманием: внезапная одно- или двухсторонняя потеря зрения: внезапное нарушение походки, головокружение, потеря равновесия или координации движений: внезапная, тяжелая или продолжительная головная боль без видимой причины: потеря сознания или обморок с эпилептическим припадком или без него. Другие признаки окклюзии сосудов: внезапная боль, отечность и слабое посинение конечностей, "острый" живот. Симптомы инфаркта миокарда: боль, дискомфорт, давление, тяжесть, чувство сжатия или распирания в груди или за грудиной, с иррадиацией в спину, челюсть, левую верхнюю конечность, область эпигастрия: холодный пот, тошнота, рвота или головокружение, сильная слабость, тревога или одышка: учащенное или нерегулярное сердцебиение. Артериальная тромбоэмболия может оказаться жизнеугрожающей или привести к летальному исходу.У женщин с сочетанием нескольких факторов риска или высокой выраженностью одного из них следует рассматривать возможность их взаимоусиления. В подобных случаях суммарное значение имеющихся факторов риска повышается. В этом случае прием препарата Ярина® противопоказан (см. раздел "Противопоказания"). Риск развития тромбоза (венозного и/или артериального) и тромбоэмболии или цереброваскулярных нарушений повышается- с возрастом- у курящих (с увеличением количества выкуриваемых сигарет или повышением возраста риск нарастает, особенно у женщин старше 35 лет):при наличии- ожирения (индекс массы тела более чем 30 кг/м 2)- семейного анамнеза (например, венозной или артериальной тромбоэмболии когда-либо у близких родственников или родителей в относительно молодом возрасте). В случае наследственной или приобретенной предрасположенности женщина должна быть осмотрена соответствующим специалистом для решения вопроса о возможности приема препарата Ярина®- длительной иммобилизации, обширного хирургического вмешательства, любой операции на нижних конечностях или обширной травмы. В этих случаях прием препарата Ярина® необходимо прекратить (в случае планируемой операции по крайней мере за четыре недели до нее) и не возобновлять прием в течение двух недель после окончания иммобилизации. Временная иммобилизация (например, авиаперелет длительностью более 4 часов) может также являться фактором риска развития венозной тромбоэмболии, особенно при наличии других факторов риска- дислипопротеинемии- артериальной гипертензии- мигрени- заболеваний клапанов сердца- фибрилляции предсердий. Вопрос о возможной роли варикозного расширения вен и поверхностного тромбофлебита в развитии ВТЭ остается спорным. Следует учитывать повышенный риск развития тромбоэмболий в послеродовом периоде. Нарушения периферического кровообращения также могут отмечаться при сахарном диабете, системной красной волчанке, гемолитико-уремическом синдроме, хронических воспалительных заболеваниях кишечника (болезнь Крона или язвенный колит) и серповидно-клеточной анемии. Увеличение частоты и тяжести мигрени во время применения КОК (что может предшествовать цереброваскулярным нарушениям) является основанием для немедленной отмены приема этих препаратов.К биохимическим показателям, указывающим на наследственную или приобретенную предрасположенность к венозному или артериальному тромбозу относится следующее: резистентность к активированному протеину С, гипергомоцистеинемия, дефицит антитромбина III, дефицит протеина С, дефицит протеина S, антифосфолипидные антитела (антитела к кардиолипину, волчаночный антикоагулянт). При оценке соотношения риска и пользы следует учитывать, что адекватное лечение соответствующего состояния может уменьшить связанный с ним риск тромбоза. Также следует учитывать, что риск тромбозов и тромбоэмболий при беременности выше, чем при приеме низкодозированных пероральных контрацептивов (<: 0,05 мг этинилэстрадиола). Опухоли. Наиболее существенным фактором риска развития рака шейки матки является персистирующая папилломавирусная инфекция. Имеются сообщения о некотором повышении риска развития рака шейки матки при длительном применении КОК. Однако связь с приемом КОК не доказана. Обсуждается возможность взаимосвязи этих данных со скринингом заболеваний шейки матки или с особенностями полового поведения (более редкое применение барьерных методов контрацепции). Мета-анализ 54 эпидемиологических исследований показал, что имеется несколько повышенный относительный риск развития рака молочной железы, диагностированного у женщин, принимающих КОК в настоящее время (относительный риск 1,24). Повышенный риск постепенно исчезает в течение 10 лет после прекращения приема этих препаратов. В связи с тем, что рак молочной железы отмечается редко у женщин до 40 лет, увеличение числа диагнозов рака молочной железы у женщин, принимающих КОК в настоящее время или принимавших недавно, является незначительным но отношению к общему риску этого заболевания. Его связь с приемом КОК не доказана. Наблюдаемое повышение риска может быть также следствием тщательного наблюдения и более ранней диагностики рака молочной железы у женщин, применяющих КОК. У женщин, когда-либо использовавших КОК, выявляются более ранние стадии рака молочной железы, чем у женщин, никогда их не применявших.В редких случаях на фоне применения КОК наблюдалось развитие доброкачественных, а в крайне редких - злокачественных опухолей печени, которые в отдельных случаях приводили к угрожающему жизни внутрибрюшному кровотечению. В случае появления сильных болей в области живота, увеличения печени или признаков внутрибрюшного кровотечения это следует учитывать при проведении дифференциального диагноза. Злокачественные опухоли могут оказаться жизнеугрожающими или привести к летальному исходу. Другие состояния. Прогестиновый компонент в препарате Ярина® является антагонистом альдостерона, обладающим калийсберегающими свойствами. В большинстве случаев не должно наблюдаться повышения концентрации калия в плазме крови. В клинических исследованиях у некоторых пациенток с легкой или умеренной почечной недостаточностью и сопутствующем приеме калийсберегающих препаратов концентрация калия в плазме крови незначительно повышалась во время приема дроспиренона. Поэтому концентрацию калия в плазме крови необходимо контролировать в течение первого цикла приема препарата у пациенток с почечной недостаточностью и при изначальной концентрации калия на верхней границе нормы, особенно при сопутствующем приеме калийсберегающих препаратов (см. раздел "Взаимодействие с другими лекарственными препаратами").У женщин с гипертриглицеридемией (или наличием этого состояния в семейном анамнезе) возможно повышение риска развития панкреатита во время приема КОК. Несмотря на то, что небольшое повышение артериального давления было описано у многих женщин, принимающих КОК, клинически значимые повышения отмечались редко. Тем не менее, если во время приема препарата развивается стойкое, клинически значимое повышение артериального давления, следует отменить эти препараты и начать лечение артериальной гипертензии. Прием препарата может быть продолжен, если с помощью гипотензивной терапии достигнуты нормальные значения артериального давления. Следующие состояния, как сообщалось, развиваются или ухудшаются как во время беременности, так и при приеме КОК, но их связь с приемом КОК не доказана: желтуха и/или зуд, связанный с холестазом: формирование камней в желчном пузыре: порфирия: системная красная волчанка: гемолитико-уремический синдром: хорея Сиденгама: герпес во время беременности: потеря слуха, связанная с отосклерозом. Также описаны случаи ухудшения течения эндогенной депрессии, эпилепсии, болезни Крона и язвенного колита на фоне применения КОК.У женщин с наследственными формами ангионевротического отека экзогенные эстрогены могут вызывать или ухудшать симптомы ангионевротического отека. Острые или хронические нарушения функции печени могут потребовать отмены препарата до тех пор, пока показатели функции печени не вернутся в норму. Рецидив холестатической желтухи, развившейся впервые во время предшествующей беременности или предыдущего приема половых гормонов, требует прекращения приема препарата. Хотя КОК могут оказывать влияние на инсулинорезистентность и толерантность к глюкозе, необходимости в коррекции дозы гипогликемических препаратов у пациенток с сахарным диабетом, использующих низкодозированные КОК (<:0,05 мг этинилэстрадиола), как правило, не возникает. Тем не менее женщины с сахарным диабетом должны тщательно наблюдаться во время приема КОК. Иногда может развиваться хлоазма, особенно у женщин с наличием в анамнезе хлоазмы беременных. Женщины со склонностью к хлоазме во время приема препарата Ярина® должны избегать длительного пребывания на солнце и воздействия ультрафиолетового излучения. Доклинические данные по безопасности. Доклинические данные, полученные в ходе стандартных исследований на предмет выявления токсичности при многократном приеме доз препарата, а также генотоксичности, канцерогенного потенциала и токсичности для репродуктивной системы, не указывают на наличие особого риска для человека. Тем не менее следует помнить, что половые гормоны могут способствовать росту некоторых гормонозависимых тканей и опухолей. Лабораторные тесты. Прием препарата Ярина® может влиять на результаты некоторых лабораторных тестов, включая показатели функции печени, почек, щитовидной железы, надпочечников, концентрацию транспортных белков в плазме, показатели углеводного обмена, параметры свертывания крови и фибринолиза. Изменения обычно не выходят за границы нормальных значений. Дроспиренон увеличивает активность ренина плазмы и концентрацию альдостерона, что связано с его антиминералокортикоидным эффектом. Снижение эффективности. Эффективность препарата Ярина® может быть снижена в следующих случаях: при пропуске таблеток, желудочно-кишечных расстройствах или в результате лекарственного взаимодействия. Частота и выраженность менструальноподобных кровотечений. На фоне приема препарата Ярина® могут наблюдаться нерегулярные (ациклические) кровотечения из влагалища ("мажущие" кровянистые выделения и/или "прорывные" маточные кровотечения), особенно в течение первых месяцев применения. Поэтому оценка любых нерегулярных менструальноподобных кровотечений должна проводиться после периода адаптации, составляющего приблизительно три цикла. Если нерегулярные менструальноподобные кровотечения повторяются или развиваются после предшествующих регулярных циклов, следует провести тщательное обследование для исключения злокачественных новообразований или беременности.У некоторых женщин во время перерыва в приеме таблеток может не развиться кровотечения "отмены". Если препарат Ярина® принимался согласно рекомендациям, маловероятно, что женщина беременна. Тем не менее при нерегулярном применении препарата и отсутствии двух подряд менструальноподобных кровотечений прием препарата не может быть продолжен до исключения беременности. Медицинские осмотры. Перед началом или возобновлением применения препарата Ярина® необходимо ознакомиться с анамнезом жизни, семейным анамнезом женщины, провести тщательное общемедицинское и гинекологическое обследование, исключить беременность. Объем исследований и частота контрольных осмотров должны основываться на существующих нормах медицинской практики при необходимом учете индивидуальных особенностей каждой пациентки. Как правило, измеряется артериальное давление, частота сердечных сокращений, определяется индекс массы тела, проверяется состояние молочных желез, брюшной полости и органов малого таза, включая цитологическое исследование эпителия шейки матки (тест по Папаниколау). Обычно контрольные обследования следует проводить не реже 1 раза в 6 месяцев. Необходимо иметь в виду, что препарат Ярина® не предохраняет от ВИЧ-инфекции (СПИД) и других заболеваний, передающихся половым путем. Состояния, требующие консультации врача- какие-либо изменения в здоровье, особенно возникновение состояний, перечисленных в разделах "Противопоказания" и "Применение с осторожностью"- локальное уплотнение в молочной железе- одновременный прием других лекарственных препаратов (см. также "Взаимодействие с другими лекарственными средствами")- если ожидается длительная неподвижность (например, на нижнюю конечность наложен гипс), планируется госпитализация или операция (по крайней мере за 4 недели до предполагаемой операции)- необычно сильное кровотечение из влагалища- пропущена таблетка в первую неделю приема упаковки и был половой контакт за семь или менее дней до этого- отсутствие очередного менструальноподобного кровотечения два раза подряд или подозрение на беременность (не следует начинать прием таблеток из следующей упаковки до консультации с врачом). Следует прекратить прием таблеток и немедленно проконсультироваться с врачом, если имеются возможные признаки тромбоза, инфаркта миокарда или инсульта: необычный кашель: необычно сильная боль за грудиной, отдающая в левую руку: неожиданно возникшая одышка, необычная, сильная и длительная головная боль или приступ мигрени: частичная или полная потеря зрения или двоение в глазах: нечленораздельная речь: внезапные изменения слуха, обоняния или вкуса: головокружение или обморок: слабость или потеря чувствительности и любой части тела: сильная боль в животе: сильная боль в нижней конечности или внезапно возникший отек любой из нижних конечностей. Влияние на способность управлять транспортными средствами: Не выявлено. Условия хранения и отпуска из аптек Условия хранения:Хранить при температуре не выше 25 °С. Хранить в недоступном для детей месте. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Ярина® Международное непатентованное название:Дроспиренон + Этинилэстрадиол. Форма выпуска:таблетки, покрытые пленочной оболочкой. Состав: Каждая таблетка, покрытая пленочной оболочкой, содержит:Ядро таблетки:активные вещества: этинилэстрадиол - 30 мкг, дроспиренон - 3 мг:вспомогательные вещества: лактозы моногидрат - 48,170 мг, крахмал кукурузный - 14,400 мг, крахмал кукурузный прежелатинизированный - 9,600 мг, повидон К25 - 4,000 мг, магния стеарат - 800 мкг. Оболочка таблетки: гипромеллоза (гидроксипропилметилцеллюлоза) - 1,0112 мг, макрогол 6000 - 202,4 мкг, тальк (магния гидросиликат) - 202,4 мкг, титана диоксид (Е 171) - 556,5 мкг, железа (II) оксид (Е 172) - 27,5 мкг. АТХ: Регистрация: Лекарственное средство П N013882/01 Фармгруппа: контрацептивное средство комбинированное (эстроген+гестаген)Дата регистрации: 02.04.2008 / 11.09.2014. Окончание регстрации: . Описание:Таблетки, покрытые пленочной оболочкой, светло-желтого цвета, с одной стороны выгравирован шестиугольник, внутри которого буквы "DO". Упаковка:Таблетки, покрытые пленочной оболочкой, 3 мг + 0,03 мг. По 21 таблетке помещают в блистер из алюминиевой фольги и поливинилхлоридной пленки. 1 или 3 блистера вместе с кармашком для ношения блистера с инструкцией по применению помещают в картонную пачку. Срок годности:3 года. Не применять по истечении срока годности. Владелец рег.удостоверения:Байер Фарма АГ Производитель:BAYER PHARMA, AG. Представительство:БАЙЕР, АО. Информация предоставлена: Компанией ГЭОТАР - http://www.lsgeotar.ru/
1434 Руб.Катэна капс. 400мг №50

Показания Лечение нейропатической боли у взрослых (18 лет и старше). Эффективность и. безопасность у пациентов в возрасте до 18 лет не установлены- Монотерапия парциальных судорог при эпилепсии со вторичной генерализацией и без нее у взрослых и детей в возрасте старше 12 лет. Эффективность и безопасность монотерапии у детей в возрасте до 12 лет не установлены- Как дополнительное средство при лечении парциальных судорог при эпилепсии со вторичной генерализацией и без нее у взрослых и детей в возрасте 3 лет и старше. Безопасность и эффективность дополнительной терапии габапентином у детей в возрасте менее 3 лет не установлены. Противопоказания Противопоказания Повышенная чувствительность к габапентину или вспомогательным компонентам препарата. Детский возраст до 3 лет. С осторожностью: Почечная недостаточность (см. "Способ применения и дозы"). Беременность Беременность. Данные о безопасности и эффективности применения препарата при беременности отсутствуют, поэтому применение габапентина при беременности возможно только в том случае, если предполагаемая польза для матери оправдывает возможный риск для плода. Лактация. Габапентин выводится с грудным молоком, поэтому во время лечения следует отказаться от грудного вскармливания. Применение и дозы Препарат Катэна® назначают внутрь, независимо от приема пищи. Если необходимо снизить дозу, отменить препарат или заменить его на альтернативное средство, это следует делать постепенно в течение минимум одной недели. Нейропатическая боль у взрослых. Начальная доза составляет 900 мг в сутки в три приема равными дозами: при необходимости, в зависимости от эффекта, дозу постепенно увеличивают до максимальной - 3600 мг/сут. Лечение можно начинать сразу с дозы 900 мг/сут (по 300 мг 3 раза в сутки) или в течение первых 3-х дней дозу можно увеличивать постепенно до 900 мг в сутки по следующей схеме:1- й день: 300 мг 1 раз в сутки 2- й день: по 300 мг 2 раза в сутки 3- й день: по 300 мг 3 раза в сутки. Парциальные судороги. Взрослые и дети в возрасте старше 12 лет: Эффективная доза - от 900 до 3600 мг в сутки. Терапию можно начать с дозы 300 мг 3 раза в сутки в первый день или увеличивать постепенно до 900 мг по схеме, описанной выше (см. раздел "Нейропатическая боль у взрослых"). В последующем доза может быть увеличена до максимальной - 3600 мг/сут в три приема равными дозами. Максимальный интервал между дозами при трехкратном приеме препарата не должен превышать 12 ч во избежание возобновления судорог. Отмечена хорошая переносимость препарата в дозах до 4800 мг/сут. Дети в возрасте 3-12 лет: Начальная доза препарата варьирует от 10 до 15 мг/кг/сут, которую назначают равными дозами 3 раза в сутки и повышают до эффективной приблизительно в течение 3-х дней. Эффективная доза габапентина у детей в возрасте 5 лет и старше составляет 25-35 мг/кг/сут равными дозами в 3 приема. Эффективная доза габапентина у детей в возрасте от 3 до 5 лет составляет 40 мг/кг/сут равными дозами в три приема. Отмечена хорошая переносимость препарата в дозах до 50 мг/кг/сут при длительном применении. Максимальный интервал между приемом доз препарата не должен превышать 12 часов во избежание возобновления судорог. Нет необходимости контролировать концентрацию габапентина в плазме. Препарат Катэна® может использоваться в комбинации с другими противосудорожными препаратами без учета изменения его концентрации в плазме или концентрации других противосудорожных препаратов в сыворотке. Подбор дозы при почечной недостаточности. Пациентам с почечной недостаточностью рекомендуется снижение дозы габапентина согласно таблице:ТАБЛИЦЪ Суточную дозу следует назначать в три приема. Назначают по 300 мг через день. Рекомендации для пациентов, находящихся на гемодиализе. Пациентам, находящимся на гемодиализе, которые ранее не принимали габапентин, препарат рекомендуется назначать в насыщающей дозе 300-400 мг, а затем применять его по 200-300 мг каждые 4 ч гемодиализа. Побочные эффекты и передозировка Побочные эффекты: Со стороны сердечно-сосудистой системы: симптомы вазодилатации, гипертензия. Со стороны пищеварительной системы: диспепсия, метеоризм, тошнота, рвота, боль в животе, запор, диарея, сухость во рту или глотке, анорексия, гингивит, заболевания зубов, увеличение аппетита, повышение активности "печеночных" трансаминаз. Со стороны опорно-двигательного аппарата: миалгия, артралгия, боль в спине, повышенная ломкость костей. Со стороны нервной системы: сонливость, головокружение, атаксия, амнезия, спутанность сознания, нарушении координации, повышенная утомляемость, нарушение мышления, тремор, гипестезия, депрессия, дизартрия, бессонница, нервозность, нистагм, усиление, ослабление или отсутствие рефлексов, астения, тревожность, враждебность, гиперкинезия, эмоциональная лабильность. Со стороны дыхательной системы: фарингит, ринит, одышка, кашель, пневмония, бронхит, респираторные инфекции. Со стороны мочеполовой системы: инфекции мочевых путей, импотенция. Со стороны органов чувств: нарушение зрения, амблиопия, диплопия. Со стороны органов кроветворения: лейкопения, пурпура (чаще всего ее описывают как кровоподтеки, возникавшие при физической травме). Аллергические реакции: кожная сыпь, зуд, акне. Прочие: лихорадка, вирусная инфекция, увеличение массы тела, боль различной локализации, периферические отеки, отек лица, головная боль. Пострегистрационный опыт применения. Зарегистрированы случаи внезапной необъяснимой смерти, связь которых с лечением габапентином не установлена. Другие нежелательные явления: острая почечная недостаточность, аллергические реакции, включая крапивницу, алопеция, ангионевротический отек, генерализованный отек: колебания концентрации глюкозы в крови у больных сахарным диабетом, боль в груди, увеличение в объеме молочных желез, гинекомастия, повышение показателей функции печени, мультиформная экссудативная эритема (в том числе синдром Стивенса-Джонсона), галлюцинации, двигательные расстройства, такие как хореоатетоз, дискинезия и дистония, сердцебиение, панкреатит, шум в ушах, тромбоцитопения, недержание мочи, миоклонус. Передозировка: Симптомы: головокружение, двоение в глазах, нарушение речи, сонливость, летаргия и диарея. Лечение: промывание желудка, прием активированного угля, симптоматическая терапия. Пациентам с тяжелой почечной недостаточностью может быть показан гемодиализ. Взаимодействие с другими ЛС: При одновременном применении габапентина и морфина, когда морфин принимался за 2 часа до приема габапентина, наблюдалось увеличение среднего значения площади под фармакокинетической кривой "концентрация - время" (AUC) габапентина на 44% по сравнению с ионотерапией габапентином, что ассоциировалось с увеличением болевого порога (холодовый прессорный тест). Клиническое значение этого изменения не установлено, фармакокинетические характеристики морфина при этом не изменялись. Побочные эффекты морфина при совместном приеме с габапентином не отличались от таковых при приеме морфина совместно с плацебо. Взаимодействия между габапентином и фенобарбиталом, фенитоином, вальпроевой кислотой и карбамазепином не отмечено. Фармакокинетика габапентина в равновесном состоянии одинакова у здоровых людей и пациентов, получающих другие противосудорожные средства. Одновременное применение габапентина с пероральными контрацептивами, содержащими норэтистерон и/или этинилэстрадиол, не сопровождалось изменениями фармакокинетики обоих компонентов. Одновременное применение габапентина с антацидами, содержащими алюминий и магний, сопровождается снижением биодоступности габапентина примерно на 20%. Габапентин рекомендуется принимать примерно через 2 ч после приема антацида. Пробенецид не влияет на почечную экскрецию габапентина. Небольшое снижение почечной экскреции габапентина при одновременном приеме циметидина, вероятно, не имеет клинического значения. Фармакологическое действие и фармакокинетика Габапентин по строению сходен с нейротрансмиттером гамма-аминомаслянной кислотой (ГАМК), однако его механизм действия отличается от такового некоторых других препаратов, взаимодействующих с ГАМК-рецепторами, включая вальпроат, барбитураты, бензодиазепины, ингибиторы ГАМК-трансаминазы, ингибиторы захвата ГАМК, агонисты ГАМК и про лекарственные формы ГАМК: он не обладает ГАМК-ергическими свойствами и не влияет за захват и метаболизм ГАМК. Предварительные исследования показали, что габапентин связывается с α 2-δ-субъединицей вольтаж-зависимых кальциевых каналов и подавляет поток ионов кальция, играющий важную роль в возникновении нейропатической боли. Другими механизмами, участвующими в действии габапентина при нейропатической боли являются: уменьшение глутамат-зависимой гибели нейронов, увеличение синтеза ГАМК, подавление высвобождения нейротрансмитгеров моноаминовой группы. Габапентин в клинически значимых концентрациях не связывается с рецепторами других распространенных препаратов или нейротрансмиттеров, включая рецепторы ГАМКА, ГАМКВ, бензодиазепиновые, глутамата, глицина или N-метил-D-аспартата. В отличие от фенитоина и карбамазепина габапентин не взаимодействует с натриевыми каналами. Фармакокинетика: Всасывание. Биодоступность габапентина не пропорциональна дозе: так, при увеличении дозы она снижается. После приема внутрь максимальная концентрация (Cmax) габапентина в плазме достигается через 2-3 ч. Абсолютная биодоступность габапентина в капсулах составляет около 60%. Пища, в том числе с большим содержанием жиров, не оказывает влияния на фармакокинетику. Выведение габапентина из плазмы лучше всего описывается с помощью линейной модели. Распределение. Фармакокинетика не меняется при повторном применении: равновесные концентрации в плазме можно предсказать на основании результатов однократного приема препарата. Габапентин практически не связывается с белками плазмы (<:3%) и имеет объем распределения 57,7 л. Метаболизм. Признаков метаболизма у человека не обнаружено. Препарат не индуцирует окислительные ферменты печени со смешанной функцией, участвующие в метаболизме лекарственных средств. Выведение. Период полувыведения (T1/2) из плазмы не зависит от дозы и составляет в среднем 5-7 ч. Выводится исключительно почками в неизмененном виде. Фармакокинетика в особых клинических случаях. Клиренс габапентина из плазмы снижается у пожилых людей и больных с нарушенной функцией почек. Константа скорости выведения, клиренс из плазмы и почечный клиренс прямо пропорциональны клиренсу креатинина. Габапентин удаляется из плазмы при гемодиализе. У больных с нарушенной функцией почек и пациентов, получающих лечение гемодиализом, рекомендуется коррекция дозы (см. Способ применения и дозы). Установлено, что концентрации габапентина в плазме у детей в возрасте от 4 до 12 лет в целом сходны с таковыми у взрослых. Особые указания При совместной терапии морфином у пациентов может произойти повышении концентрации габапентина. При этом необходимо обеспечить тщательное наблюдение за пациентами на предмет развития такого признака угнетения центральной нервной системы (ЦНС), как сонливость. В этом случае доза габапентина или морфина должна быть адекватно снижена (см. "Взаимодействие с другими лекарственными средствами"). Лабораторные исследования. При совместном применении габапентина и других противосудорожных средств были зарегистрированы ложноположительные результаты при определении белка.в моче с помощью тест-полосок Ames N-Multistix SG®. Для определения белка в моче рекомендуется пользоваться более специфичным методом преципитации сульфосалициловой кислотой. Влияние на способность управлять транспортными средствами: В период лечения необходимо воздержаться от вождения автотранспорта и занятий потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций. Условия хранения и отпуска из аптек Условия хранения:При температуре не выше 25°С. Хранить в недоступном для детей месте! Отпуск из аптек: По рецепту Регистрационные данные Торговое название Катэна® Международное непатентованное название:Габапентин. Форма выпуска:капсулы. Состав:Одна капсула содержит:Капсулы 100 мг: активное вещество: габапентин - 100 мг: вспомогательные вещества: лактозы моногидрат, крахмал кукурузный, тальк: капсульная оболочка: титана диоксид (Е 171), желатин. Капсулы 300 мг: активное вещество: габапентин - 300 мг: вспомогательные вещества: лактозы моногидрат, крахмал кукурузный, тальк: капсульная оболочка: титана диоксид (Е 171), краситель железа оксид желтый (Е 172), желатин. Капсулы 400 мг: активное вещество: габапентин - 400 мг: вспомогательные вещества: лактозы моногидрат, крахмал кукурузный, тальк: капсульная оболочка: титана диоксид (Е 171), краситель железа оксид желтый (Е 172), краситель железа оксид красный (Е 172), желатин. АТХ: Регистрация: Лекарственное средство ЛСР-002168/10 Фармгруппа: Противоэпилептическое средство. Дата регистрации: 17.03.2010 / 07.06.2010. Окончание регстрации: . Описание:Капсулы 100 мг: белый кристаллический порошок в капсульной оболочке белого цвета, размер 3. Капсулы 300 мг: белый кристаллический порошок в капсульной оболочке желтого цвета, размер 1. Капсулы 400 мг: белый кристаллический порошок в капсульной оболочке оранжевого цвета, размер 0. Упаковка:Капсулы 100 мг, 300 мг, 400 мг. Капсулы 100 мг: По 10 капсул в ПВХ/Ал блистере. Два блистера помещают вместе с инструкцией по применению в картонную пачку. Капсулы 300 мг и 400 мг: По 10 капсул в ПВХ/Ал блистере. Пять блистеров помещают вместе с инструкцией по применению в картонную пачку. Срок годности:3 года. Не применять по истечении срока годности. Владелец рег.удостоверения:БЕЛУПО, лекарства и косметика д.д. Производитель:BELUPO, Pharmaceuticals &: Cosmetics, d.d. Представительство:БЕЛУПО, лекарства и косметика д.д
834 Руб.Редуксин капс. 15мг №60
Показания Редуксин показан для снижения массы тела при следующих состояниях: алиментарное ожирение с индексом массы тела (ИМТ) 30 кг/м 2 и более:алиментарное ожирение с индексом массы тела 27 кг/м 2 и более в сочетании с сахарным диабетом 2 типа и дислипидемией. Противопоказания Противопоказания - установленная повышенная чувствительность к сибутрамину или к другим компонентам препарата: - наличие органических причин ожирения (например, гипотиреоз): - серьезные нарушения питания - нервная анорексия или нервная булимия: - психические заболевания: - синдром Жиль де ля Туретта (генерализованные тики): - одновременный прием ингибиторов МАО (например, фентермина, фенфлурамина, дексфенфлурамина, этиламфетамина, эфедрина) или применение в течение 2 недель до приема препарата Редуксин и 2 недель после окончания его приема других препаратов, действующих на центральную нервную систему, ингибирующих обратный захват серотонина (например, антидепрессантов, нейролептиков): снотворных препаратов, содержащих триптофан, а также других препаратов центрального действия для снижения массы тела или для лечения психических расстройств: - сердечно-сосудистые заболевания (в анамнезе и в настоящее время): ишемическая болезнь сердца (инфаркт миокарда (ИМ), стенокардия): хроническая сердечная недостаточность в стадии декомпенсации, окклюзирующие заболевания периферических артерий, тахикардия, аритмия, цереброваскулярные заболевания (инсульт, транзиторные нарушения мозгового кровообращения): - неконтролируемая артериальная гипертензия (артериальное давление (АД) выше 145/90 мм рт.ст.) (см. также раздел "Особые указания"): - тиреотоксикоз: - тяжелые нарушения функции печени и/или почек: - доброкачественная гиперплазия предстательной железы: - феохромоцитома: - закрытоугольная глаукома: - установленная фармакологическая, наркотическая или алкогольная зависимость: - беременность и период грудного вскармливания: - возраст до 18 лет и старше 65 лет. С осторожностью: С осторожностью следует назначать препарат при следующих состояниях: аритмии в анамнезе, хронической недостаточности кровообращения, заболеваниях коронарных артерий (в том числе в анамнезе), кроме ишемической болезни сердца (ИМ, стенокардии): глаукоме, кроме закрытоугольной глаукомы, холелитиазе, артериальной гипертензии (контролируемой и в анамнезе), неврологических нарушениях, включая задержку умственного развития и судороги (в том числе в анамнезе), эпилепсии, нарушении функции печени и/или почек легкой и средней степени тяжести, моторных и вербальных тиках в анамнезе, склонности к кровотечению, нарушению свертываемости крови, приеме препаратов, влияющих на гемостаз или функцию тромбоцитов. Беременность Поскольку до настоящего времени не имеется достаточно большого количества исследований в отношении безопасности воздействия сибутрамина на плод, данный препарат противопоказан в период беременности. Женщины, находящиеся в репродуктивном возрасте, во время приема препарата Редуксин должны пользоваться контрацептивными средствами. Противопоказано принимать Редуксин во время грудного вскармливания. Применение и дозы Редуксин принимается внутрь 1 раз в сутки. Дозу устанавливают индивидуально, в зависимости от переносимости и клинической эффективности. Рекомендуется начальная доза 10 мг/сутки, при плохой переносимости возможен прием 5 мг/сут. Капсулы следует принимать утром, не разжевывая и запивая достаточным количеством жидкости (стакан воды). Препарат можно принимать как натощак, так и сочетать с приемом пищи. Если в течение 4 недель от начала лечения не достигнуто снижение массы тела менее 2 кг, то доза увеличивается до 15 мг/сут. Лечение препаратом Редуксин не должно продолжаться более 3 месяцев у пациентов, которые недостаточно хорошо реагируют на терапию, т.е. которым в течение 3 месяцев лечения не удается достичь снижения массы тела на 5 % от исходного показателя. Лечение не следует продолжать, если при дальнейшей терапии, после достигнутого снижения массы тела, пациент вновь прибавляет в массе тела 3 кг и более. Длительность лечения не должна превышать 1 года, поскольку в отношении более продолжительного периода приема сибутрамина данные об эффективности и безопасности отсутствуют. Лечение препаратом Редуксин должно осуществляться в комплексе с диетой и физическими упражнениями под контролем врача, имеющего практический опыт лечения ожирения. Побочные эффекты и передозировка Побочные эффекты: Чаще всего побочные эффекты возникают в начале лечения (в первые 4 недели). Их выраженность и частота с течением времени ослабевают. Побочные эффекты носят, в целом, нетяжелый и обратимый характер. Побочные эффекты, в зависимости от воздействия на органы и системы органов, представлены в следующем порядке: очень часто (>: 10 %), часто ( 1 %, но 10 %). Со стороны центральной нервной системы очень частыми побочными эффектами являются сухость во рту и бессонница, часто отмечаются головная боль, головокружение, беспокойство, парестезии, а также изменение вкуса. Со стороны сердечно-сосудистой системы часто встречаются тахикардия, ощущение сердцебиения, повышение артериального давления, вазодилатация. Со стороны системы органов пищеварения очень часто наблюдаются потеря аппетита и запор, часто тошнота и обострение геморроя. При склонности к запорам в первые дни необходим контроль за эвакуаторной функцией кишечника. При возникновении запора прием прекращают и принимают слабительное. Со стороны кожных покровов часто отмечается повышенное потоотделение. В единичных случаях при лечении сибутрамином описаны следующие нежелательные клинически значимые явления: дисменорея, отеки, гриппоподобный синдром, зуд кожи, боль в спине, боль в животе, парадоксальное повышение аппетита, жажда, ринит, депрессия, сонливость, эмоциональная лабильность, тревожность, раздражительность, нервозность, острый интерстициальный нефрит, кровотечения, пурпура Шенлейн-Геноха (кровоизлияния в кожу), судороги, тромбоцитопения, транзиторное повышение активности "печеночных" ферментов в крови. Изменения сердечно-сосудистой системы. Наблюдается умеренный подъем артериального давления в покое на 1-3 мм рт.ст. и умеренное увеличение пульса на 3-7 ударов в минуту. В отдельных случаях не исключаются более выраженные повышения артериального давления и частоты сердечных сокращений. Клинически значимые изменения артериального давления и пульса регистрируются преимущественно в начале лечения (в первые 4-8 недель). Применение препарата Редуксин у пациентов с повышенным артериальным давлением: смотри раздел "Противопоказания" и "Особые указания". В ходе постмаркетинговых исследований были описаны дополнительные побочные реакции, перечисленные ниже по системам органов: Со стороны сердечно-сосудистой системы: мерцательная аритмия. Со стороны иммунной системы: реакции гиперчувствительности (от умеренных высыпаний на коже и крапивницы до ангионевротического отека (отека Квинке) и анафилаксии). Психические расстройства: психоз, состояния суицидально направленного мышления, суицид и мания. При возникновении подобных состояний препарат необходимо отменить. Со стороны нервной системы: судороги, кратковременные нарушения памяти. Со стороны органа зрения: затуманивание зрения ("пелена перед глазами"). Со стороны системы органов пищеварения: диарея, рвота. Со стороны кожи и подкожной клетчатки: алопеция. Со стороны почек и мочевыводящих путей: задержка мочи. Со стороны репродуктивной системы: нарушения эякуляции/оргазма, импотенция, нарушение менструального цикла, маточные кровотечения. Передозировка: Имеются крайне ограниченные данные по поводу передозировки сибутрамина. Наиболее часто встречающиеся неблагоприятные реакции, связанные с передозировкой: тахикардия, повышение артериального давления, головная боль, головокружение. Следует известить своего лечащего врача в случае предполагаемой передозировки. Специального лечения и специфических антидотов не существует. Необходимо выполнять общие мероприятия: обеспечить свободное дыхание, наблюдать за состоянием сердечно-сосудистой системы, а также, при необходимости, осуществить поддерживающую симптоматическую терапию. Своевременное применение активированного угля, а также промывание желудка может уменьшить поступление сибутрамина в организм. Пациентам с повышенным артериальным давлением и тахикардией можно назначить бета-адреноблокаторы. Эффективность форсированного диуреза или гемодиализа не установлена. Взаимодействие с другими ЛС: Ингибиторы микросомального окисления, в том числе ингибиторы изофермента CYP3 А4 (кетоконазол, эритромицин, циклоспорин и др.) повышают в плазме крови концентрации метаболитов сибутрамина с повышением частоты сердечных сокращений и клинически несущественным увеличением интервала QT. Рифампицин, антибиотики из группы макролидов, фенитоин, карбамазепин, фенобарбитал и дексаметазон могут ускорять метаболизм сибутрамина. Одновременное применение нескольких препаратов, повышающих содержание серотонина в плазме крови, может привести к развитию серьезного взаимодействия. Так называемый серотониновый синдром может развиться в редких случаях при одновременном применении препарата Редуксин с селективными ингибиторами обратного захвата серотонина (препаратами для лечения депрессии), с некоторыми препаратами для лечения мигрени (суматриптан, дигидроэрготамин), с сильнодействующими анальгетиками (пентазоцин, петидин, фентанил) или противокашлевыми препаратами (декстрометорфан). Сибутрамин не влияет на действие пероральных контрацептивных средств. При одновременном приеме сибутрамина и алкоголя не было отмечено усиления негативного действия алкоголя. Однако алкоголь абсолютно не сочетается с рекомендуемыми при приеме сибутрамина диетическими мероприятиями. При одновременном применении с сибутрамином других препаратов, влияющих на гемостаз или функцию тромбоцитов, увеличивается риск развития кровотечений. Лекарственное взаимодействие при одновременном применении сибутрамина с препаратами, повышающими артериальное давление и частоту сердечных сокращений, в настоящее время недостаточно полно изучено. Эта группа препаратов включает деконгестанты, противокашлевые, противопростудные и противоаллергические препараты, в состав которых входят эфедрин или псевдоэфедрин. Поэтому в случаях одновременного приема этих препаратов с сибутрамином следует соблюдать осторожность. Совместное применение сибутрамина с препаратами для снижения массы тела, действующими на центральную нервную систему, или препаратами для лечения психических расстройств противопоказано. Фармакологическое действие и фармакокинетика Редуксин - комбинированный препарат, действие которого обусловлено входящими в его состав компонентами. Сибутрамин является пролекарством и проявляет свое действие за счет метаболитов (первичных и вторичных аминов), ингибирующих обратный захват моноаминов (серотонина, норадреналина и дофамина). Увеличение содержания в синапсах нейротрансмиттеров повышает активность центральных 5НТ-серотониновых и адренергических рецепторов, что способствует увеличению чувства насыщения и снижению потребности в пище, а также увеличению термопродукции. Опосредованно активируя бета 3-адренорецепторы, сибутрамин воздействует на бурую жировую ткань. Снижение массы тела сопровождается увеличением концентрации в плазме крови липопротеинов высокой плотности (ЛПВП) и понижением количества триглицеридов, общего холестерина, липопротеинов низкой плотности (ЛПНП) и мочевой кислоты. Сибутрамин и его метаболиты не влияют на высвобождение моноаминов, не ингибируют моноаминооксидазу (МАО): обладают низким сродством к большому числу нейромедиаторных рецепторов, включая серотониновые (5-HT1, 5HT1A, 5-Н1В, 5-НТ2С), адренергические (бета 1, бета 2, бета 3, альфа 1, альфа 2), дофаминовые (D1, D2), мускариновые, гистаминовые (H1), бензодиазепиновые и глутаматные (NMDA) рецепторы. Целлюлоза микрокристаллическая является энтеросорбентом, обладает сорбционными свойствами и неспецифическим дезинтоксикационным действием. Связывает и выводит из организма различные микроорганизмы, продукты их жизнедеятельности, токсины экзогенной и эндогенной природы, аллергены, ксенобиотики, а также избыток некоторых продуктов обмена веществ и метаболитов, ответственных за развитие эндогенного токсикоза. Фармакокинетика: После приема внутрь быстро всасывается из желудочно-кишечного тракта (ЖКТ) не менее чем на 77 %. При "первичном прохождении" через печень подвергается биотрансформации под влиянием изофермента CYP3A4 с образованием двух активных метаболитов (монодесметилсибутрамин (M1) и дидесметилсибутрамин (М2)). После приема разовой дозы 15 мг максимальная концентрация в плазме крови (Cmax) M1 составляет 4 нг/мл (3,2-4,8 нг/мл), М2 - 6,4 нг/мл (5,6-7,2 нг/мл). Сmах достигается через 1,2 ч (сибутрамин), 3-4 ч (M1 и М2). Одновременный прием пищи понижает Сmах метаболитов на 30 % и увеличивает время ее достижения на 3 часа, не изменяя площадь под кривой "концентрация-время" (AUC). Быстро распределяется по тканям. Связь с белками составляет 97 % (сибутрамин) и 94 % (M1 и М2). Равновесная концентрация активных метаболитов в плазме крови достигается в течение 4 дней после начала применения и примерно в 2 раза превышает концентрацию в плазме крови после приема разовой дозы. Период полувыведения сибутрамина - 1,1 часа, M1 - 14 часов, М2 -16 часов. Активные метаболиты подвергаются гидроксилированию и конъюгации с образованием неактивных метаболитов, которые выводятся преимущественно почками. Имеющиеся в настоящее время ограниченные данные не указывают на существование клинически значимых различий в фармакокинетике у мужчин и женщин. Фармакокинетика у пожилых здоровых лиц (средний возраст 70 лет) аналогична таковой у молодых. Почечная недостаточность Почечная недостаточность не оказывает действия на AUC активных метаболитов M1 и М2, кроме метаболита М2 у пациентов с терминальной стадией почечной недостаточности, находящихся на диализе. Печеночная недостаточность У пациентов с умеренной печеночной недостаточностью после однократного приема сибутрамина AUC активных метаболитов M1 и М2 на 24 % выше, чем у здоровых лиц. Особые указания Редуксин следует применять только в тех случаях, когда все немедикаментозные мероприятия по снижению массы тела малоэффективны - если снижение массы тела в течение 3 месяцев составило менее 5 кг. Лечение препаратом Редуксин должно осуществляться в рамках комплексной терапии по снижению массы тела под контролем врача, имеющего практический опыт лечения ожирения. Комплексная терапия включает в себя как изменение диеты и образа жизни, так и увеличение физической активности. Важным компонентом терапии является создание предпосылок к стойкому изменению пищевого поведения и образа жизни, которые необходимы для сохранения достигнутого снижения массы тела и после отмены медикаментозной терапии. Пациентам необходимо в рамках терапии препаратом Редуксин изменить свой жизненный уклад и привычки таким образом, чтобы после завершения лечения обеспечить сохранение достигнутого уменьшения массы тела. Пациенты должны четко представлять себе, что несоблюдение этих требований приведет к повторному увеличению массы тела и повторным обращениям к лечащему врачу. У пациентов, принимающих Редуксин, необходимо регулярно измерять артериальное давление и частоту сердечных сокращений. В первые 3 месяца лечения эти параметры следует контролировать каждые 2 недели, а затем ежемесячно. Если во время двух визитов подряд выявляется увеличение частоты сердечных сокращений в покое 10 ударов в минуту или систолического/диастолического давления 10 мм рт.ст, необходимо прекратить лечение. У пациентов с артериальной гипертензией, у которых на фоне гипотензивной терапии артериальное давление выше 145/90 мм рт.ст, этот контроль должен проводиться особенно тщательно и, при необходимости, через более короткие интервалы. У пациентов, у которых артериальное давление дважды при повторном измерении превышало уровень 145/90 мм рт.ст, лечение препаратом Редуксин должно быть отменено (см. раздел "Побочное действие"). У пациентов с синдромом апноэ во сне необходимо особенно тщательно контролировать артериальное давление. Особого внимания требует одновременное назначение препаратов, увеличивающих интервал QT. К этим препаратам относятся Н1-гистаминоблокаторы (астемизол, терфенадин): антиаритмические препараты, увеличивающие интервал QT (амиодарон, хинидин, флекаинид, мексилетин, пропафенон, соталол): стимулятор моторики желудочно-кишечного тракта цизаприд: пимозид, сертиндол и трициклические антидепрессанты. Это касается и состояний, которые способны приводить к увеличению интервала QT, таких как, гипокалиемия и гипомагниемия (см. также раздел "Взаимодействие с другими лекарственными средствами"). Интервал между приемом ингибиторов МАО (в том числе фуразолидона, прокарбазина, селегилина) и препарата Редуксин должен составлять не менее 2 недель. Хотя не установлена связь между приемом препарата Редуксин и развитием первичной легочной гипертензии, однако, учитывая общеизвестный риск препаратов данной группы, при регулярном медицинском контроле необходимо особое внимание обращать на такие симптомы, как прогрессирующее диспноэ (нарушение дыхания), боль в грудной клетке и отеки на ногах. При пропуске дозы препарата Редуксин не следует принимать в следующий прием двойную дозу препарата, рекомендовано продолжать дальнейший прием препарата по предписанной схеме. Длительность приема препарата Редуксин не должна превышать 1 года. При совместном приеме сибутрамина и других ингибиторов обратного захвата серотонина существует повышенный риск развития кровотечений. У пациентов, предрасположенных к кровотечениям, а также принимающих препараты, влияющие на гемостаз или функцию тромбоцитов, сибутрамин следует применять с осторожностью. Хотя клинические данные о привыкании к сибутрамину отсутствуют, следует выяснить, не было ли в анамнезе пациента случаев лекарственной зависимости, и обратить внимание на возможные признаки злоупотребления лекарственными препаратами. Влияние на способность управлять транспортными средствами: Прием препарата Редуксин может ограничить способность к управлению транспортными средствами и механизмами. В период применения препарата Редуксин необходимо соблюдать осторожность при управлении транспортными средствами и занятии другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций. Условия хранения и отпуска из аптек Условия хранения:В сухом месте при температуре не выше + 25 °С. Хранить в недоступном для детей месте. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Редуксин Международное непатентованное название:Сибутрамин + Целлюлоза микрокристаллическая. Форма выпуска:Капсулы. Состав:Состав на 1 капсулу для дозировки 10 мг +158.5 мг: Активные вещества: Сибутрамина гидрохлорида моногидрат - 10 мг: целлюлоза микрокристаллическая - 158,5 мг. Вспомогательные вещества: Кальция стеарат - 1,5 мг Состав капсулы: титана диоксид - 2,0000 %, краситель азорубин - 0,0041 %, краситель бриллиантовый голубой - 0,0441 %, желатин - до 100 %. Состав на 1 капсулу для дозировки 15 мг + 153,5 мг: Активные вещества: Сибутрамина гидрохлорида моногидрат - 15 мг: целлюлоза микрокристаллическая - 153,5 мг. Вспомогательные вещества: Кальция стеарат - 1,5 мг Состав капсулы: титана диоксид - 2,0000 %, краситель синий патентованный - 0,2737 %, желатин - до 100 %. АТХ: Регистрация: Лекарственное средство ЛС-002110 Фармгруппа: Средство лечения ожирения. Дата регистрации: 18.02.2013. Окончание регстрации: . Описание:Капсулы № 2 голубого цвета для дозировки 10 мг + 158,5 мг или синего цвета для дозировки 15 мг + 153,5 мг. Содержимое капсул - порошок белого или белого со слегка желтоватым оттенком цвета. Упаковка:Капсулы 10 мг + 158,5 мг: капсулы 15 мг + 153,5 мг. По 7, 10, 14 или 15 капсул в контурную ячейковую упаковку из пленки ПВХ и фольги алюминиевой печатной лакированной. При производстве на ООО "ОЗОН": По 7, 10, 14, 15, 28, 30, 60, 90, 120, 150, 160 или 180 капсул в контейнер полимерный для лекарственных средств. Один контейнер или 1, 2, 3, 4, 6, 8, 9,10, 12, 15, 16, 18 или 20 контурных ячейковых упаковок вместе с инструкцией по применению помещают в пачку из картона. При производстве на ФГУП "Московский эндокринный завод": 1, 2, 3, 4, 6, 8, 9,10, 12, 15, 16, 18 или 20 контурных ячейковых упаковок вместе с инструкцией по применению помещают в пачку из картона. Срок годности:3 года. Не применять по истечению срока годности. Владелец рег.удостоверения:Промомед Рус, ООО Производитель:ОЗОН, ООО. Представительство
6598 Руб.Но-шпа р-р в/в и в/м 2% 2мл №5

Показания спазмы гладкой мускулатуры, связанные с заболеваниями желчевыводящих путей: холецистолитиаз, холангиолитиаз, холецистит, перихолецистит, холангит, папиллит. - спазмы гладкой мускулатуры мочевыводящих путей: нефролитиаз, уретролитиаз, пиелит, цистит, тенезмы мочевого пузыря. В качестве вспомогательной терапии (когда форма таблеток не может быть применена): - при спазмах гладкой мускулатуры желудочно-кишечного происхождения: язвенная болезнь желудка и двенадцатиперстной кишки, гастрит, спазмы кардии и привратника, энтерит, колит - при гинекологических заболеваниях: дисменорея. Противопоказания Противопоказания Гиперчувствительность к действующему веществу или к любому из вспомогательных веществ препарата. Гиперчувствительность к натрия дисульфиту (смотри раздел "Особые указания"). Тяжелая печеночная или почечная недостаточность. Тяжелая хроническая сердечная недостаточность. Детский возраст (применение дротаверина у детей в клинических исследованиях не изучалось). Период кормления грудью. С осторожностью: При артериальной гипотензии (опасность коллапса, смотри раздел "Особые указания"): У беременных женщин (смотри раздел "Беременность и период лактации") Беременность Как показали исследования по репродуктивной токсичности у животных и ретроспективные исследования клинических данных, применение дротаверина в период беременности не оказывало ни тератогенного, ни эмбриотоксического действия. Несмотря на это при назначении дротаверина беременным женщинам следует соблюдать осторожность и применять его только в тех случаях, когда потенциальная польза для матери превышает потенциальный риск для плода, при этом следует избегать назначения инъекционной лекарственной формы препарата Но-шпа® у беременных женщин. Препарат не следует применять во время родов (потенциальный риск развития послеродовых атонических кровотечений). В связи с отсутствием необходимых клинических данных в период лактации назначать препарат не рекомендуется. Применение и дозы Взрослые: Суточная средняя доза составляет 40-240 мг дротаверина гидрохлорида (разделенная на 1-3 дозы в сутки) внутримышечно. При острых коликах (почечной или желчно-каменной) - 40-80 мг внутривенно-медленно (продолжительность введения приблизительно 30 секунд). Побочные эффекты и передозировка Побочные эффекты: Ниже представлены неблагоприятные реакции, наблюдавшиеся в клинических исследованиях, разделенные по системам органов с указанием частоты их возникновения в соответствии со следующими градациями: очень частые (>:10%), частые (>:1% и <:10%): нечастые (>:0,1 и <:1%): редкие (>:0,01% и <:0,1%) и очень редкие, включая отдельные сообщения (<:0,01 %), неизвестная частота (по имеющимся данным частоту определить нельзя). Со стороны сердечно-сосудистой системы Редкие - учащение сердцебиения, снижение артериального давления. Со стороны нервной системы Редкие - головная боль, головокружение, бессонница. Со стороны желудочно-кишечного тракта Редко - тошнота, запор. Со стороны иммунной системы Редкие - аллергические реакции (ангионевротический отек, крапивница, сыпь, зуд) (смотри раздел "Противопоказания"). Неизвестная частота При применении препарата сообщалось о развития анафилактического шока со смертельным исходом и без смертельного исхода. Местные реакции Редкие - реакции в месте введения. Передозировка: Передозировка дротаверина ассоциировалась с нарушениями сердечного ритма и проводимости, включая полную блокаду ножек пучка Гиса и остановку сердца, которая может быть фатальной. В случае передозировки пациенты должны находиться под тщательным медицинским наблюдением и им следует проводить симптоматическую терапию и лечение, направленное на поддержание основных функций организма. Взаимодействие с другими ЛС: С леводопа Ингибиторы фосфодиэстеразы, подобные папаверину, ослабляют противопаркинсонический эффект леводопы. При назначении дротаверина одновременно с леводопа возможно усиление ригидности и тремора. С папаверином, бендазолом и другими спазмолитиками (в том числе и м-холинолитиками) Дротаверин усиливает спазмолитическое действие папаверина, бендазола и других спазмолитиков, включая м-холиноблокаторы. С трициклическими антидепрессантами, хинидином и прокаинамидом Усиливает гипотензию, вызываемую трициклическими антидепрессантами, хинидином и прокаинамидом. С морфином Снижает спазмогенную активность морфина. С фенобарбиталом Фенобарбитал усиливает спазмолитическое действие дротаверина. Фармакологическое действие и фармакокинетика Дротаверин представляет собой производное изохинолина, которое проявляет мощное спазмолитическое действие на гладкую мускулатуру за счет ингибирования фермента фосфодиэстеразы (ФДЭ). Фермент фосфодиэстераза необходим для гидролиза ц-АМФ до АМФ. Ингибирование фермента фосфодиэстеразы приводит к повышению концентрации ц-АМФ, которое запускает следующую каскадную реакцию: высокие концентрации ц-АМФ активируют ц-АМФ зависимое фосфорилирование киназы легких цепей миозина (КЛЦМ). Фосфорилирование КЛЦМ приводит к снижению ее аффинности к кальций (Са 2+)-кальмодулиновому комплексу, в результате чего инактивированная форма КЛЦМ поддерживает мышечное расслабление. ц-АМФ кроме этого влияет на цитозольную концентрацию Са 2, благодаря стимулированию транспорта Са 2+ в экстрацеллюлярное пространство и саркоплазматический ретикулум. Этот понижающий концентрацию С2+ эффект дротаверина через ц-АМФ объясняет антагонистический эффект дротаверина по отношению к Са 2. In vitro дротаверин ингибирует изофермент ФДЭ-4, без ингибирования изоферментов ФДЭ-3 и ФДЭ-5. Поэтому эффективность дротаверина зависит от концентраций ФДЭ-4 в тканях, содержание которой в разных тканях различается. ФДЭ-4 наиболее важна для подавления сократительной активности гладкой мускулатуры, в связи с чем селективное ингибирование ФДЭ-4 может быть полезным для лечения гиперкинетических дискинезий и различных заболеваний, сопровождающихся спастическим состоянием желудочно-кишечного тракта. Гидролиз ц-АМФ в миокарде и гладкой мускулатуре сосудов происходит главным образом с помощью изоэнзима ФДЭ-3, чем объясняется тот факт, что при высокой спазмолитической активности у дротаверина отсутствуют серьезные побочные эффекты со стороны сердца и сосудов и выраженные эффекты в отношении сердечно-сосудистой системы. Дротаверин эффективен при спазмах гладкой мускулатуры как нейрогенного, так и мышечного происхождения. Независимо от типа вегетативной иннервации, дротаверин расслабляюще действует на гладкую мускулатуру желудочно-кишечного тракта, желчевыводящих путей, мочеполовой системы. Фармакокинетика: Дротаверин и/или его метаболиты могут незначительно проникать через плацентарный барьер. In vitro - дротаверин имеет высокую связь с белками плазмы (95-97%), особенно с альбумином, у и β- глобуминами, а также а-ЛПВП (липопротеидами высокой плотности). У человека дротаверин почти полностью метаболизируется путем О-дезэтилирования. Его метаболиты быстро конъюгируют с глюкуроновой кислотой. Главным метаболитом является 4’-дезэтилдротаверин, кроме которого были идентифицированы 6- дезэтилдротаверин и 4’-дезэтилдротавералдин. У человека для оценки показателей фармакокинетики дротаверина использовалась двухкамерная математическая модель. Конечный период полувыведения плазменной радиоактивности составлял 16 часов. Период полувыведения составляет 8-10 часов. За 72 ч. практически полностью выводится из организма, более 50% через почки (преимущественно в виде метаболитов) и около 30% через кишечник. Неизменный дротаверин в моче не обнаруживается. Особые указания Препарат содержит дисульфит, который может вызывать реакции аллергического типа, включая анафилактические симптомы и бронхоспазм у чувствительных лиц, особенно у лиц с астмой или аллергическими заболеваниями в анамнезе. В случае повышенной чувствительности к дисульфиту парентерального применения препарата следует избегать (смотри раздел "Противопоказания"). При внутривенном введении дротаверина у пациентов с пониженным артериальным давлением больной должен находиться в горизонтальном положении в связи с риском развития коллапса. Влияние на способность управлять транспортными средствами: В период лечения необходимо воздерживаться от управления транспортными средствами и занятий другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций. Условия хранения и отпуска из аптек Условия хранения:Хранить в защищенном от света месте при температуре 15-25 °С. Хранить в недоступном для детей месте. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Но-шпа® Международное непатентованное название:Дротаверин. Форма выпуска:раствор для внутривенного и внутримышечного введения. Состав:В одной ампуле (2 мл) содержится действующее вещество: дротаверина гидрохлорид - 40 мг: вспомогательные вещества: натрия дисульфит (натрия метабисульфит) -2,0 мг, этанол 96 % - 132,0 мг, вода для инъекций до 2,0 мл. АТХ: Регистрация: Лекарственное средство П N011854/01 Фармгруппа: спазмолитическое средство. Дата регистрации: 27.07.2010. Окончание регстрации: . Описание:Прозрачная жидкость зеленовато-желтого цвета. Упаковка:Раствор для внутривенного и внутримышечного введения 20 мг/мл. По 2 мл в ампулы из темного стекла (гидролитического класса, тип I) с нанесенной точкой разлома. По 5 ампул в пластиковую контурную ячейковую упаковку без покрытия (поддон). По 1 или 5 поддонов с инструкцией по применению в картонную пачку. Срок годности:5 лет. Не применять после истечения срока годности, указанного на упаковке. Владелец рег.удостоверения:ХИНОИН Завод Фармацевтических и Химических продуктов, ЗАО Производитель:CHINOIN Pharmaceutical and Chemical Works, Co. Ltd. Представительство:Санофи Россия, АО
115 Руб.Сейзар таб. 100мг №30

Показания Эпилепсия Взрослые и дети (старше 12 лет) эпилепсия (парциальные и генерализованные припадки, включая тонико-клонические судороги, а также припадки при синдроме Леннокса-Гасто) в составе комбинированной терапии или монотерапии. Дети от 3-х до 12 лет эпилепсия (парциальные и генерализованные припадки, включая тонико-клонические судороги, а также припадки при синдроме Леннокса-Гасто) в составе комбинированной терапии. После достижения контроля эпилепсии на фоне комбинированной терапии, сопутствующие противоэпилептические препараты (ПЭП) могут быть отменены и прием ламотриджина продолжен в монотерапии. Монотерапия типичных абсансов. - Биполярные расстройства Взрослые (18 лет и старше)для предупреждения нарушений настроения (депрессии, мании, гипомании, смешанных эпизодов) у больных с биполярным расстройством. Противопоказания Противопоказания Повышенная чувствительность к ламотриджину или любому компоненту препарата. Детский возраст до 3-х лет (для данной лекарственной формы). С осторожностью: Хроническая почечная недостаточность, аллергические реакции или кожная сыпь на прием других противоэпилептических препаратов в анамнезе. Беременность Фертильность. Изучение репродуктивной функции животных не выявило нарушения фертильности при назначении ламотриджина. Исследования по влиянию ламотриджина на фертильность человека не проводились. Беременность. Постмаркетинговые наблюдения позволили задокументировать исходы беременности около 1000 женщин, получавших монотерапию ламотриджином в течение первого триместра беременности. Полученные при этом данные показали, что риски серьезных врожденных аномалий сопоставимы со средним риском в общей популяции. Однако, по другим данным, нельзя исключить повышение риска развития "заячьей губы". Ламотриджин должен назначаться при беременности только в том случае, если ожидаемая терапевтическая польза для матери превышает риск для плода. Физиологические изменения, развивающиеся при беременности, могут оказывать влияние на уровень ламотриджина и/или его терапевтический эффект. Имеются сообщения о снижении концентрации ламотриджина во время беременности. Назначение ламотриджина беременным должно быть обеспечено соответствующей тактикой ведения больных. Лактация. Информация о применении ламотриджина во время кормления грудью ограничена. По предварительным данным ламотриджин проникает в грудное молоко в концентрациях соответствующих примерно 40-60% от концентрации в плазме матери.У небольшого числа младенцев, находившихся на грудном вскармливании, концентрации ламотриджина в плазме крови достигают значений, при которых может развиться фармакологический эффект. Необходимо соотносить потенциальную пользу кормления грудным молоком и потенциальный риск развития побочных эффектов у младенца. Применение и дозы Таблетки принимаются внутрь. В случае возобновления приема Сейзара врачи должны оценить необходимость повышения поддерживающей дозы у больных, прекратившие прием препарата по каким-либо причинам, поскольку высокие начальные дозы и превышение рекомендуемых доз ассоциируются с риском развития тяжелой кожной сыпи. Чем больше прошло времени после последнего приема препарата, тем с большей осторожностью следует повышать дозу до поддерживающей. Если время после прекращения приема превышает 5 периодов полувыведения, то доза Сейзара должна повышаться до поддерживающей согласно соответствующей схеме. Терапию Сейзаром не следует возобновлять у пациентов, прекращение лечения которых было связано с появлением сыпи, кроме случаев, когда потенциальная польза от такой терапии очевидно превышает возможные риски. Эпилепсия Монотерапия больных эпилепсией Взрослые и дети старше 12 лет - табл. 1 Начальная доза Сейзара при монотерапии составляет 25 мг один раз в сутки в течение 2-х недель с последующим повышением дозы до 50 мг один раз в сутки в течение 2-х недель. Затем дозу следует увеличивать на 50-100 мг каждые 1-2 недели, пока не будет достигнут оптимальный терапевтический эффект. Стандартная поддерживающая доза для достижения оптимального терапевтического эффекта составляет 100-200 мг в сутки в один или два приема. Некоторым пациентам для достижения желаемого терапевтического эффекта требуется доза до 500 мг/сут. Дети в возрасте от 3-х до 12 лет - табл. 2 Детям от 3 до 12 лет в начале терапии и для повышения дозы использовать таблетки с дозировкой 5 мг. Начальная доза Сейзара при монотерапии больных с типичными абсансами составляет 0,3 мг/кг массы тела/сут в один или два приема в течение 2-х недель с последующим повышением дозы до 0,6 мг/кг массы тела/сут в один или два приема в течение 2-х недель. Затем дозу следует повышать максимально на 0,6 мг/кг каждые 1-2 недели до тех пор, пока не будет достигнут оптимальный терапевтический эффект. Обычная поддерживающая доза для достижения оптимального терапевтического эффекта составляет от 1 до 15 мг/кг массы тела/сут в один или два приема, хотя некоторым пациентам с типичными абсансами для достижения терапевтического эффекта требуются более высокие дозы. Из-за риска развития сыпи не следует превышать начальную дозу препарата и рекомендованный режим повышения доз. В составе комбинированной терапии больных эпилепсией Взрослые и дети старше 12 лет - табл. 1 У пациентов, которые уже получают валъпроевую кислоту в сочетании с другими ПЭП или без них, начальная доза Сейзара составляет 25 мг через день в течение 2-х недель, в дальнейшем - по 25 мг один раз в сутки в течение 2-х недель. Затем дозу следует увеличивать максимально на 25-50 мг/сут каждые 1-2 недели, пока не будет достигнут оптимальный терапевтический эффект. Обычная поддерживающая доза для достижения оптимального терапевтического эффекта составляет 100-200 мг в сутки в один или два приема. У тех больных, которые получают сопутствующую терапию ПЭП ши другие препараты, которые стимулируют глюкуронизацию ламотриджина, в сочетании ши без других ПЭП (за исключением вальпроевой кислоты), начальная доза Сейзара составляет 50 мг один раз в сутки в течение 2-х недель, в дальнейшем - 100 мг/сут в два приема в течение 2-х недель. Затем доза увеличивается максимально на 100 мг каждые 1-2 недели, пока не будет достигнут оптимальный терапевтический эффект. Обычная поддерживающая доза составляет 200-400 мг в сутки в два приема. Некоторым пациентам для достижения желаемого терапевтического эффекта может потребоваться доза 700 мг/сут. У больных, которые принимают окскарбазепин в сочетании с какими-либо другими индукторами или ингибиторами глюкуронизации ламотриджина или без них, начальная доза Сейзара составляет 25 мг один раз в сутки в течение 2-х недель, в дальнейшем - 50 мг/сут в один прием в течение 2-х недель. Затем доза увеличивается максимально на 50-100 мг каждые 1-2 недели, пока не будет достигнут оптимальный терапевтический эффект. Обычная поддерживающая доза составляет 100-200 мг в сутки в один или два приема. Таблица 1: Рекомендуемый режим дозирования при лечении эпилепсии взрослых и детей старше 12 лет ТАБЛИЦЪ Прекращение терапии ламотриджином у больных с биполярным расстройством: Во время клинических испытаний резкая отмена ламотриджина не вызывала увеличения частоты, тяжести или изменения характера нежелательных явлений по сравнению с плацебо. Таким образом пациентам можно отменять ламотриджин сразу без постепенного снижения его дозы. Дети и подростки младше 18 лет Ламотриджин не показан при биполярных расстройствах детям и подросткам младше 18 лет. Безопасность и эффективность ламотриджина при биполярном расстройстве у пациентов этой возрастной группы не оценивалась. Общие рекомендации при дозировке ламотриджина у особых категорий больных Женщины, принимающие гормональные контрацептивы а) Назначение ламотриджина больным, уже получающим гормональные контрацептивы: Несмотря на то, что оральные гормональные контрацептивы повышают клиренс ламотриджина, специальные режимы повышения доз ламотриджина не разрабатывались. Режим повышения доз должен соответствовать рекомендуемым указаниям в зависимости от того, добавляется ли ламотриджин к ингибитору глюкуронизации ламотриджина, например, вальпроевой кислоте: добавляется ли ламотриджин к индуктору глюкуронизации ламотриджина, например, карбамазепину, фенитоину, фенобарбиталу, примидону или рифампицину: или он назначается в отсутствие вальпроевой кислоты, карбамазепина, фенитоина, фенобарбитала, примидона или рифампицина (см. табл. 1 для эпилепсии и табл. 3 для биполярного расстройства). б) Назначение гормональных контрацептивов больным, уже получающим поддерживающие дозы ламотриджина и не получающим индукторов глюкуронизации ламотриджина: Может потребоваться повышение поддерживающей дозы ламотриджина, но не более, чем в 2 раза в зависимости от индивидуального клинического эффекта. в) Прекращение приема гормональных контрацептивов больными, уже получающими поддерживающие дозы ламотриджина и не получающих индукторов глюкуронизации ламотриджина: Может потребоваться снижение дозы ламотриджина в 2 раза в зависимости от индивидуального клинического эффекта. Пациенты пожилого возраста (старше 65 лет) Фармакокинетика ламотриджина в этой возрастной группе практически не отличается от таковой у других взрослых, поэтому изменения схемы подбора доз препарата не требуется. Нарушение функции печени Начальную, возрастающую и поддерживающую дозы следует уменьшить приблизительно на 50% и 75% у пациентов с умеренной (стадия В) и тяжелой (стадия С) степенью печеночной недостаточности соответственно. Возрастающая и поддерживающая дозы должны корректироваться в зависимости от клинического эффекта. Нарушение функции почек Больным с почечной недостаточностью Сейзар следует назначать с осторожностью. При конечной стадии почечной недостаточности начальная доза Сейзара вычисляется в соответствии со стандартной схемой назначения препарата: для пациентов со значительным снижением функции почек может быть рекомендовано снижение поддерживающей дозы. Побочные эффекты и передозировка Побочные эффекты: Доступная информация о побочных действиях разделена на два раздела: побочные действия у больных с эпилепсией и побочные действия у больных с биполярным расстройством. Однако, при рассмотрении профиля безопасности ламотриджина в целом необходимо принимать во внимание сведения обоих разделов. Использована следующая условная классификация частоты развития побочных действий: очень часто ( >:1/10), часто (>:1/100, <:1/10), не очень часто (>:1/1000, <:1/100), редко (>:1/10000, <:1/1000), очень редко (<: 1/10000). Эпилепсия Нарушения со стороны кожи и подкожной ткани При монотерапии Очень часто: кожные высыпания В составе комбинированной терапии Очень часто: кожные высыпания Редко: синдром Стивенса-Джонсона Очень редко: токсический эпидермальный некролиз В двойных слепых клинических исследованиях, где ламотриджин применялся в качестве комбинированной терапии, частота развития кожной сыпи у больных, принимавших ламотриджин, составляла 10 %, а у больных принимавших плацебо - 5 %. В 2 % случаев возникновения кожной сыпи послужило причиной отмены ламотриджина. Кожная сыпь в основном пятнисто-папулезного характера, обычно проявляется в течение первых 8 недель с момента начала терапии и проходит после отмены препарата. Имеются сообщения о редких случаях развития тяжелых, потенциально опасных для жизни поражениях кожи, включающих синдром Стивенса-Джонсона и токсический эпидермальный некролиз (синдром Лайелла). Хотя в большинстве случаев при отмене препарата происходило обратное развитие симптомов, у некоторых больных остались рубцы, а в редких случаях были зарегистрированы смертельные исходы, связанные с приемом препарата. Общий риск развития кожной сыпи в значительной степени был связан с : высокой начальной дозой ламотриджина и превышением рекомендуемых темпов наращивания доз ламотриджина: сопутствующим назначением вальпроевой кислоты: развитие сыпи также рассматривалось как проявление синдрома гиперчувствительности, связанного с различными системными проявлениями. Нарушения со стороны крови и лимфатической системы Очень редко: гематологические нарушения, включающие нейтропению, лейкопению, анемию, тромбоцитопению, панцитопению, апластическую анемию, агранулоцитоз. Гематологические нарушения могут быть, а могут и не быть связаны с синдромом гиперчувствительности. Нарушения со стороны иммунной системы Очень редко: синдром гиперчувствительности (включая такие симптомы, как лихорадка, лимфаденопатия, отечность лица, нарушения со стороны крови и функции печени, синдром диссеминированного внутрисосудистого свертывания (ДВС), мультиорганные нарушения. Сыпь также рассматривается как часть синдрома гиперчувствительности, связанного с различными системными проявлениями, включая лихорадку, лимфаденопатию. Отечность лица, нарушения со стороны крови и функции печени. Синдром протекает с различной степенью тяжести и может в редких случаях приводить к развитию синдрома ДВС и мультиорганным нарушениям. Важно отметить, что ранние проявления гиперчувствительности (т.е лихорадка, лимфаденопатия) могут иметь место даже при отсутствии явных признаков сыпи. При развитии подобных симптомов больной должен быть немедленно осмотрен врачом, если не будет установлена другая причина симптомов, ламотриджин должен быть отменен. Психические нарушения Часто: раздражительность Не очень часто: агрессивность Очень редко: тики, галлюцинации, спутанность сознания Нарушения со стороны нервной системы При монотерапии Очень часто: головная боль Часто: сонливость, бессонница, головокружение, тремор Не очень часто: атаксия В составе комбинированной терапии Очень часто: головная боль, головокружение Часто: нистагм, тремор, атаксия, сонливость, бессонница Очень редко: ажитация, неустойчивость, двигательные расстройства, ухудшения симптомов болезни Паркинсона, экстрапирамидные расстройства, хореоатетоз, повышение частоты судорожных припадков. Имеются сообщения о том, что ламотриджин может ухудшать симптомы паркинсонизма у больных с уже имеющейся болезнью Паркинсона, а в единичных случаях вызывать экстрапирамидные симптомы и хореатетоз у больных без предшествующих нарушений. Нарушения со стороны органов зрения Очень часто: диплопия, нечеткость зрения Редко: конъюнктивит. Желудочно- кишечные нарушения При монотерапии Часто: тошнота В составе комбинированной терапии Часто: желудочно-кишечные нарушения, включая тошноту и диарею. Гепатобилиарные нарушения Очень редко: повышение уровней печеночных ферментов, нарушение функции печени, печеночная недостаточность. Нарушения функции печени обычно развиваются в сочетании с симптомами гиперактивности, но в единичных случаях отмечались и в отсутствии явных признаков гиперчувствительности. Нарушения со стороны скелетно-мышечной и соединительной тканей Очень редко: волчаноподобный синдром Нарушения общего характера Часто: утомляемость Биполярное нарушение Для оценки общего профиля безопасности ламотриджина нижеприведенные побочные действия должны приниматься во внимание наряду с характерными для эпилепсии. Нарушения со стороны кожи и подкожной ткани Очень часто: кожная сыпь Редко: синдром Стивенса-Джонсона При оценке всех исследований (контролируемых и неконтролируемых) по изучению ламотриджина у больных с биполярными нарушениями кожная сыпь возникала у 14 % всех больных, получавших ламотриджин, тогда как частота кожной сыпи только в контролируемых исследованиях составляла 9 % у больных, получивших ламотриджин, и у 8 % у больных, получавших плацебо. Нарушения со стороны нервной системы Очень часто: головная боль Часто: ажитация , сонливость, головокружение Нарушения со стороны скелетно-мышечной и соединительной тканей Часто: артралгия Нарушения общего характера. Часто: боль, боль в спине Передозировка: Сообщалось об однократном введении доз, превышающих максимальные терапевтические дозы в 10-20 раз. Передозировка проявилась симптомами, включающими нистагм, атаксию, нарушения сознания до комы. Лечение: госпитализация и проведение соответствующей симптоматической терапии. В случае недавнего (менее 2 часов) приема препарата необходимо провести промывание желудка. Взаимодействие с другими ЛС: УДФ-глюкуронилтрансфераза является основным ферментом, метаболизирующим ламотриджин. Нет данных о способности ламотриджина вызывать клинически значимую индукцию или ингибирование окислительных ферментов печени. В этой связи взаимодействие между ламотриджином и препаратами, метаболизирующимися системой ферментов цитохрома Р450, маловероятно. Ламотриджин может стимулировать свой собственный метаболизм, но этот эффект выражен умеренно и не имеет клинически значимых последствий. Таблица 6: Влияние других препаратов на глюкуронизацию ламотриджина ТАБЛИЦЪ Влияние других пероральных контрацептивов и гормонально-заместительной терапии не изучалось, хотя они могут оказывать подобное влияние на фармакокинетические показатели ламотриджина. Взаимодействия с ПЭП Вальпроевая кислота, которая подавляет глюкуронизацию ламотриджина, снижает скорость его метаболизма и удлиняет его средний период полувыведения почти в 2 раза. Определенные ПЭП (такие как фенитоин, карбамазепин, фенобарбитал и примидон), которые стимулируют систему метаболизирующих ферментов печени, ускоряют глюкуронизацию ламотриджина и его метаболизм. Сообщалось о развитии побочных действий со стороны ЦНС, включавших головокружение, атаксию, диплопию, нечеткость зрения и тошноту у больных, начавших принимать карбамазепин на фоне терапии ламотриджином. Эти симптомы обычно проходили после снижения дозы карбамазепина. Аналогичный эффект наблюдался при назначении ламотриджина и окскарбазепина здоровым добровольцам, результат снижения доз не изучался. Исследования показали, что ламотриджин не влияет на концентрации в плазме крови сопутствующих ПЭП. Результаты исследований in vitro показали, что ламотриджин не вытесняет другие ПЭП из связи с белками плазмы крови. При одновременном назначении ламотриджина в дозе 200 мг и окскарбазепина в дозе 1200 мг, ни окскарбазепин, ни ламотриджин не нарушают метаболизм друг друга. Взаимодействия при комбинированном применении с другими психотропными средствами Многократный прием бупропиона внутрь не оказывает статистически значительного влияния на фармакокинетику однократной дозы ламотриджина и вызывает незначительное увеличение AUC (площади под кривой "концентрация-время") ламотриджина глюкуронида. Оланзапин в дозе 15 мг снижает AUC и Сmax ламотриджина в среднем на 24 % и 20 % соответственно, что клинически незначимо. Ламотриджин в дозе 200 мг не изменяет кинетики оланзапина. Ингибирование метаболизма ламотриджина амитриптилином, бупропионом, клоназепамом, флуоксетином, галоперидолом или лоразепамом оказывает минимальное влияние на образование первичного метаболита ламотриджина 2-N-глюкуронида. Изучение метаболизма буфуралола микросомальными ферментами печени, выделенными у человека, позволяет сделать вывод, что ламотриджин не снижает клиренс препаратов, метаболизирующихся преимущественно изоферментами CYP2D6. Результаты исследований in vitro также позволяют предположить, что клозапин, фенелзин, рисперидон, сертралин или тразодон вряд ли могут оказывать влияние на клиренс ламотриджина. Взаимодействия с гормональными контрацептивами Влияние гормональных контрацептивов на фармакокинетику ламотриджина Прием комбинированных пероральных контрацептивов, содержащих 30 мкг этинилэстрадиола и 150 мкг левоноргестрела, вызывает приблизительно двукратное повышении клиренса ламотриджина (после его приема внутрь), что приводит к снижению AUC и Сmax ламотриджина в среднем на 52% и 39% соответственно. В течение недели, свободной от приема активного препарата, наблюдается повышение плазменной концентрации ламотриджина, при этом концентрация ламотриджина, измеренная в конце этой недели перед введением следующей дозы, в среднем в 2 раза выше, чем в период активной терапии. Влияние ламотриджина на фармакокинетику гормональных контрацептивов В период равновесных концентраций ламотриджин в дозе 300 мкг не влияет на фармакокинетику этинилэстрадиола - компонента комбинированного перорального контрацептива. Отмечается небольшое повышение клиренса второго компонента перорального контрацептива - левоноргестрела, что приводило к снижению AUC и Сmax левоноргестрела на 19% и 12% соответственно. Измерение сывороточных ФСГ, ЛГ и эстрадиола во время этого исследования выявило небольшое уменьшение подавления гормональной активности яичников у некоторых женщин, хотя измерение плазменного прогестерона ни у одной из 16 женщин не выявило гормональных подтверждений овуляции. Влияние умеренного повышения клиренса левоноргестрела и изменения плазменных уровней ФСГ и ЛГ на овуляционную активность яичников не установлено. Влияние других доз ламотриджина (кроме 300 мг/день) не изучалось и исследования с включением других гормональных препаратов не проводилось. Взаимодействия с другими препаратами Рифампицин повышает клиренс ламотриджина и снижает его период полувыведения благодаря стимуляции печеночных ферментов, ответственных за глюкуронизацию. Больным, получающим рифампицин в качестве сопутствующей терапии, режим назначения ламотриджина должен соответствовать схеме, рекомендуемой при совместном назначении ламотриджина и средств, стимулирующих глюкуронизацию. Совместим с седативными ЛС и анксиолитиками. Миелотоксические ЛС усиливают проявления гематотоксичности препарата. Фармакологическое действие и фармакокинетика Ламотриджин является блокатором потенциал-зависимых натриевых каналов. Снижает патологическую активность нейронов без угнетения их функции. Стабилизирует нейрональные мембраны посредством влияния на Na-каналы, блокирует избыточный выброс глутамата, не снижая его нормальное высвобождение. Фармакокинетика: Всасывание. Ламотриджин быстро и полностью всасывается из кишечника, практически не подвергаясь пресистемному метаболизму первого прохождения. Максимальная концентрация в плазме достигается приблизительно через 2,5 ч после перорального приема препарата. Время достижения максимальной концентрации слегка увеличивается после приема пищи, но степень абсорбции остается неизменной. Фармакокинетика имеет линейный характер при приеме однократной дозы до 450 мг (наибольшая исследованная доза). Наблюдаются значительные межиндивидуальные колебания максимальной концентрации в равновесном состоянии, однако, с редкими колебаниями у каждого отдельного человека. Распределение. Ламотриджин связывается с белками плазмы приблизительно на 55%. Маловероятно, чтобы высвобождение препарата из связи с белком могло приводить к развитию токсического эффекта. Объем распределения составляет 0,92-1,22 л/кг. Метаболизм. В метаболизме ламотриджина принимает участие фермент уридиндифосфат-глюкуронилтрансфераза (УДФ-глюкуронилтрансфераза). Ламотриджин в небольшой степени повышает свой собственный метаболизм в зависимости от дозы. Однако нет никаких данных, подтверждающих, что ламотриджин влияет на фармакокинетику других противоэпилептических препаратов и что между ламотриджином и другими препаратами, метаболизирующимися системой цитохрома Р450, возможно взаимодействие. Выведение. У здоровых взрослых клиренс ламотриджина в состоянии равновесных концентраций составляет в среднем 39±14 мл/мин. Ламотриджин метаболизируется до глюкуронидов, которые выводятся почками. Менее 10% препарата выводится почками в неизмененном виде, около 2% - кишечником. Клиренс и период полувыведения не зависят от дозы. Период полувыведения у здоровых взрослых людей составляет в среднем от 24 ч до 35 ч. У больных с синдромом Жильбера наблюдалось снижение клиренса препарата на 32% по сравнению с контрольной группой, что, однако не выходило за границы нормальных значений для общей популяции. На период полувыведения ламотриджина большое влияние оказывают совместно принимаемые лекарственные препараты. Средний период полувыведения снижается приблизительно до 14 ч при одновременном назначении с препаратами, стимулирующими глюкуронизацию, такими как карбамазепин и фенитоин, и повышается в среднем до 70 ч при совместном назначении с вальпроевой кислотой. Особые группы больных Дети У детей клиренс ламотриджина при расчете на массу тела выше, чем у взрослых: он наиболее высок у детей до 5 лет. У детей период полувыведения ламотриджина обычно короче, чем у взрослых. Его среднее значение приблизительно равняется 7 ч при одновременном назначении с препаратами, стимулирующими глюкуронизацию, такими как карбамазепин и фенитоин, и повышается в среднем до 45-50 ч при совместном назначении с вальпроевой кислотой (см. разделы "Способ применения и дозы", "Взаимодействия"). Пациенты пожилого возраста Клинически значимые различия в клиренсе ламотриджина у больных пожилого возраста в сравнении с молодыми пациентами не обнаружены. Пациенты с нарушением функции почек При нарушении функции почек начальная доза ламотриджина вычисляется в соответствии со стандартной схемой назначения противоэпилептического препарата. Снижение дозы может потребоваться только при значительном снижении функции почек. Пациенты с нарушением функции печени Начальная, возрастающая и поддерживающая дозы должны быть уменьшены приблизительно на 50% у пациентов с умеренной степенью печеночной недостаточности (стадия В по Чайлд-Пью) и на 75% - у пациентов с тяжелой степенью печеночной недостаточности (стадия С по Чайлд-Пью). Увеличение дозы и поддерживающая доза должны корректироваться в зависимости от клинического эффекта. Клиническая эффективность у пациентов с биполярными расстройствами Эффективность в предотвращении расстройств настроения у пациентов с биполярными расстройствами была продемонстрирована в двух фундаментальных клинических исследованиях. В результате комбинированного анализа полученных результатов было установлено, что продолжительность ремиссии, определявшаяся как время до возникновения первого эпизода депрессии и до первого эпизода мании/гипомании/смешанного после стабилизации, дольше в группе ламотриджина по сравнению с плацебо. Продолжительность ремиссии более выражена для депрессии. Особые указания Кожная сыпь Имеются сообщения о побочных действиях со стороны кожи, которые могут возникать в течение первых 8 недель после начала терапии ламотриджином. Большинство высыпаний носит легкий характер и проходит самостоятельно, однако есть сообщения о высыпаниях, потребовавших госпитализации пациента и прекращения приема ламотриджина. Они включали такие потенциально жизнеугрожающие кожные реакции как синдром Стивенса- Джонсона и токсический эпидермальный некролиз (синдром Лайелла). Тяжелые кожные реакции у взрослых больных, использующих ламотриджин в соответствии с общепринятыми рекомендациями, развиваются с частотой примерно 1 на 500 больных эпилепсией. Примерно в половине этих случаев зарегистрирован синдром Стивенса- Джонсона (1 на 1000). У больных с биполярными расстройствами частота тяжелых кожных высыпаний по данным клинических исследований составляет приблизительно 1 на 1000 больных. У детей риск развития тяжелых кожных высыпаний выше, чем у взрослых. По имеющимся данным частота кожных высыпаний, потребовавших госпитализации, у детей, больных эпилепсией, составляла от 1 на 300 до 1 на 100 детей. У детей начальные проявления сыпи могут быть ошибочно приняты за инфекцию, поэтому врачи должны принимать во внимание возможность реакции детей на препарат, проявляющейся развитием сыпи и лихорадки в первые 8 недель терапии. Кроме того, суммарный риск развития сыпи в значительной мере связан с: - высокой начальной дозой ламотриджина и превышением рекомендуемой скорости' повышения доз ламотриджина: - комбинированным применением с вальпроевой кислотой. При обнаружении сыпи все пациенты (взрослые и дети) должны быть сразу осмотрены врачом. Прием ламотриджина должен быть немедленно прекращен за исключением тех случаев, когда очевидно, что развитие сыпи не связано с приемом препарата. Не рекомендуется возобновлять прием ламотриджина в случаях, когда его предшествующее назначение было отменено в связи с развитием кожной реакции, если только ожидаемый терапевтический эффект от применения препарата не превышает риск побочных эффектов. Сообщалось, что кожная сыпь может быть частью синдрома гиперчувствительности, связанного с различными системными проявлениями, включая лихорадку, лимфаденопатию, отечность лица и нарушения со стороны крови и печени. Тяжесть проявления синдрома варьирует в широких пределах и в редких случаях может приводить к развитию синдрома ДВС, полиорганной недостаточности. Необходимо отметить, что ранние проявления синдрома гиперчувствительности (т.е. лихорадка, лимфаденопатия) могут наблюдаться, даже если нет явных проявлений сыпи. При развитии подобных симптомов больной должен быть немедленно осмотрен врачом и, если не будет установлена другая причина симптомов, ламотриджин должен быть отменен. Гормональные контрацептивы Влияние гормональных контрацептивов на фармакокинетику ламотриджина Было показано, что комбинированный препарат этинилэстрадиол/левоноргестрел (30 мкг/150 мкг) приблизительно в 2 раза повышает клиренс ламотриджина, что приводит к снижению уровня ламотриджина в плазме (см. "Взаимодействия"). При его назначении для достижения максимального терапевтического эффекта необходимо повышение поддерживающих доз ламотриджина, но не более, чем в 2 раза. У женщин уже не принимающих индукторы глюкуронизации ламотриджина и принимающих гормональные контрацептивы, схема лечения которых включает неделю приема неактивного препарата (или недельный перерыв в приеме контрацептива), в этот период времени будет наблюдаться постепенное транзиторное повышение концентрации ламотриджина. Повышение концентрации будет выражено больше, если очередное увеличение дозы ламотриджина будет проводиться непосредственно до или в период приема неактивного препарата. Для получения инструкций по дозированию см. "Общие рекомендации по дозированию ламотриджина в особых группах больных", "Способ применения и дозы". Клиницисты должны овладеть клиническими навыками ведения женщин, которые на фоне лечения ламотриджином начинают или прекращают принимать гормональные контрацептивы, поскольку это может потребовать коррекции дозировок ламотриждина. Другие пероральные контрацептивы и гормонально-заместительная терапия не были изучены, хотя они могут подобным образом влиять на фармакокинетические параметры ламотриджина. Влияние ламотриджина на фармакокинетику гормональных контрацептивов Совместное назначение ламотриджина и комбинированного гормонального контрацептива (этинилэстрадиол/левоноргестрел) приводит к умеренному повышению клиренса левоноргестрела и изменениям концентрации фолликулостимулирующего (ФСГ) и лютеинизирующего гормонов. Влияние этих изменений на овуляторную активность яичников неизвестно. Однако нельзя исключить возможность, что у некоторых больных, принимающих ламотриджин и гормональные контрацептивы, эти изменения могут вызвать снижение эффективности контрацептивов. Такие больные должны быть проинструктированы о необходимости немедленно сообщать врачу об изменениях в характере менструального цикла, т.е. о внезапных кровотечениях. Дегидрофолатредуктаза Ламотриджин является слабым ингибитором дегидрофолатредуктазы, поэтому существует вероятность вмешательства препарата в метаболизм фолатов при его длительном назначении. Однако было показано, что ламотриджин не вызывал существенных изменений концентрации гемоглобина, среднего объема эритроцитов, при концентрации фолатов эритроцитов сыворотки длительности назначения препарата до 1 года и не снижал концентрации фолатов в эритроцитах при назначении ламотриджина длительностью до 5 лет. Почечная недостаточность Однократное назначение ламотриджина больным в конечной стадии почечной недостаточности не выявило значительных изменений концентрации препарата. Однако накопление глюкуронидного метаболита весьма вероятно, поэтому необходимо проявлять осторожность при лечении больных с почечной недостаточностью. Больные, принимающие другие препараты, содержащие ламотриджин Нельзя назначать ламотриджин больным, уже получающим какие-либо другие препараты, содержащие ламотриджин без консультации врача. Эпилепсия Резкая отмена приема ламотриджина, как и других ПЭП, может спровоцировать развитие судорог. Если резкое прекращение терапии не является требованием безопасности (например, при появлении сыпи), дозу ламотриджина следует снижать постепенно в течение 2-х недель. В литературе имеются сообщения о том, что тяжелые судорожные приступы, включая эпилептический статус, могут привести к развитию рабдомиолиза, мультиорганных нарушений и ДВС коагуляции иногда с фатальным исходом. Подобные случаи наблюдались и при лечении больных ламотриджином. Биполярные расстройства Дети и подростки младше 18 лет Лечение антидепрессантами связано с увеличением рисков суицидальных мыслей и поведения у детей и подростков со серьезными депрессивными расстройствами и другими психиатрическими нарушениями. Клиническое ухудшение и суицидальные риски, связанные с биполярными расстройствами В клинических исследованиях с участием пациентов с биполярными расстройствами, частота развития суицидальных мыслей или поведения имела тенденцию к более высоким значениям в группе ламотриджина по сравнению с группой плацебо. Пациенты, страдающие биполярными расстройствами, могут испытывать ухудшение симптомов депрессии и/или появление суицидальных мыслей и поведения не зависимо от того, принимают они или нет препараты для лечения биполярных расстройств. При наблюдении за такими больными необходимо тщательно мониторировать симптомы клинического ухудшения (включая появление новых симптомов) и суицидальности, особенно в начале курса лечения и в момент изменения дозы. Больные группы повышенного риска, которые имели в анамнезе суицидальные мысли или поведение, молодые пациенты и те пациенты, которые проявляли значительное повышение суицидальных идей по сравнению с началом терапии, рискующих проявить суицидальные мысли и суицидальные попытки, должны находиться под тщательным наблюдением во время лечения. Пациенты (и лица, осуществляющие уход за пациентами) должны быть предупреждены о необходимости наблюдения за любыми ухудшениями состояния пациентов (включая появление новых симптомов) и/или появлением суицидальных идей/поведения или мыслей о причинении вреда себе и обратиться за медицинской помощью немедленно, если эти симптомы имеются. При этом следует оценить ситуацию и внести соответствующие изменения в режим терапии, включая возможность отмены препарата у пациентов, которые испытывают клиническое - ухудшение (включая появление новых симптомов) и/или появление суицидальных мыслей/поведения, особенно, если эти симптомы характеризуются тяжестью, внезапными приступами и ранее не проявлялись. Должно быть принято решение об изменении режима дозирования, включая возможную отмену препарата у пациентов, у которых отмечается клиническое ухудшение (включая появление новых симптомов) и/или появление суицидальных мыслей/поведения, особенно если эти симптомы протекают тяжело, в форме внезапных приступов или не проявлялись до лечения. Влияние на способность управлять транспортными средствами: В период лечения необходимо соблюдать осторожность при вождении автотранспорта и занятии другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций. Эпилепсия Так как эффект всех противоэпилептических средств имеет индивидуальную вариабельность, то больные должны проконсультароваться со своим врачом о возможности водить машину. Условия хранения и отпуска из аптек Условия хранения:В защищенном от света месте, при температуре 15-25 °С, недоступном для детей месте. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Сейзар Международное непатентованное название:Ламотриджин. Форма выпуска:Таблетки. Состав:Активное вещество: одна таблетка содержит ламотриджина 25 мг, 50 мг, 100 мг и 200 мг. Вспомогательные вещества: гипролоза низкозамещенная, кальция карбонат, карбоксиметилкрахмал натрия, кремния диоксид коллоидный, магния алюмосиликат, магния стеарат, натрия сахаринат, повидон, целлюлоза микрокристаллическая, ароматизатор черносмородиновый. АТХ: Регистрация: Лекарственное средство ЛСР-005944/09 Фармгруппа: Противоэпилептическое средство. Дата регистрации: 21.07.2009. Окончание регстрации: . Описание: Таблетки 25 мг: белые, круглые, двояковыпуклые таблетки. Таблетки 50 мг. 100 мг и 200 мг: белые, круглые, двояковыпуклые таблетки с риской на одной стороне. Упаковка:Таблетки 25 мг, 50 мг, 100 мг, 200 мг. Таблетки 25 мг. По 10 таблеток в блистере из алюминиевой фольги и пленки ПВХ. По 3 блистера (30 таблеток) вместе с инструкцией по применению помещают в картонную пачку. Таблетки 50 мг. По 10 таблеток в блистере перфорированном из алюминиевой фольги и пленки ПВХ. По 3 блистера (30 таблеток) вместе с инструкцией по применению помещают в картонную пачку. Таблетки 100 мг и 200 мг. По 15 таблеток в блистере перфорированном из алюминиевой фольги и пленки ПВХ. По 2 блистера (30 таблеток) вместе с инструкцией по применению помещают в картонную пачку. Срок годности:3 года. Не использовать по истечении срока годности, указанного на упаковке. Владелец рег.удостоверения:Алкалоид, АО Производитель:Алкалоид АО. Представительство
1174 Руб.Роаккутан капс. 10мг №30
Показания Тяжелые формы акне (узелково-кистозные, конглобатные акне или акне с риском образования рубцов). Акне, не поддающиеся другим видам терапии. Противопоказания Противопоказания Беременность, период кормления грудью (см. раздел "Беременность и период грудного вскармливания"), печеночная недостаточность, гипервитаминоз А, выраженная гиперлипидемия, сопутствующая терапия тетрациклинами. Повышенная чувствительность к препарату или его компонентам (в том числе к сое). Детский возраст до 12 лет. С осторожностью: Депрессия в анамнезе, сахарный диабет, ожирение, нарушение липидного обмена, алкоголизм. Беременность Беременность - абсолютное противопоказание для терапии препаратом Роаккутан. Если беременность возникает, несмотря на предостережения, во время лечения или в течение месяца после окончания терапии, существует очень большая опасность рождения ребенка с тяжелыми пороками развития. Изотретиноин - препарат с сильным тератогенным действием. Если беременность возникает в тот период, когда женщина перорально принимает изотретиноин (в любой дозе и даже непродолжительное время), существует очень большая опасность рождения ребенка с пороками развития. Роаккутан противопоказан женщинам детородного возраста, если только состояние женщины не удовлетворяет всем нижеперечисленным критериям: - у нее должна быть тяжелая форма акне, устойчивая к обычным методам лечения- она должна точно понимать и выполнять указания врача: - она должна быть информирована врачом об опасности наступления беременности в ходе лечения препаратом Роаккутан в течение одного месяца после него и срочной консультации при подозрении на наступление беременности: - она должна быть предупреждена о возможной неэффективности средств контрацепции: - она должна подтвердить, что понимает суть мер предосторожности: - она должна понимать необходимость и непрерывно использовать эффективные методы контрацепции в течение одного месяца до лечения препаратом Роаккутан, во время лечения и в течение месяца после его окончания (см. раздел "Взаимодействие с другими лекарственными средствами"): желательно использовать одновременно 2 различных способа контрацепции, включая барьерный: - у нее должен быть получен отрицательный результат достоверного теста на беременность в пределах 11 дней до начала приема препарата: тест на беременность настоятельно рекомендуется проводить ежемесячно во время лечения и через 5 недель после окончания терапии: - она должна начинать лечение препаратом Роаккутан только на 2-3 день следующего нормального менструального цикла: - она должна понимать необходимость обязательного посещения врача каждый месяц: - при лечении по поводу рецидива заболевания она должна постоянно пользоваться теми же эффективными методами контрацепции в течение одного месяца до начала лечения препаратом Роаккутан, во время лечения и в течение месяца после его завершения, а так же проходить тот же достоверный тест на беременность: - она должна полностью понимать необходимость мер предосторожности и подтвердить свое понимание и желание применять надежные методы контрацепции, которые ей объяснил врач. Использование противозачаточных средств по вышеприведенным указаниям во время лечения изотретиноином следует рекомендовать даже тем женщинам, которые обычно не применяют методов контрацепции из-за бесплодия (за исключением пациенток, перенесших гистерэктомию), аменореи или которые сообщают, что не ведут половую жизнь. Врач должен быть уверен, что: - у пациентки тяжелая форма акне (узелково-кистозные, конглобатные акне или акне с риском образования рубцов): акне, не поддающиеся другим видам терапии: - получен отрицательный результат достоверного теста на беременность до начала приема препарата, во время терапии и через 5 недель после окончания терапии: даты и результаты проведения теста на беременность необходимо документировать: - пациентка использует не менее 1, предпочтительно 2 эффективных метода контрацепции, включая барьерный метод, в течение одного месяца до начала лечения препаратом Роаккутан, во время лечения и в течение месяца после его окончания: - пациентка способна понимать и выполнять все вышеперечисленные требования по предохранению от беременности: - пациентка соответствует всем вышеперечисленным условиям. Тест на беременность В соответствии с существующей практикой, тест на беременность с минимальной чувствительностью 25 мМЕ/мл следует проводить в первые 3 дня менструального цикла: До начала терапии: - Для исключения возможной беременности до начала применения контрацепции результат и дата первоначального теста на беременность должны быть зарегистрированы врачом. У пациенток с нерегулярными менструациями время проведения теста на беременность зависит от сексуальной активности, его следует проводить через 3 недели после незащищенного полового акта. Врач должен проинформировать пациентку о методах контрацепции. - Тест на беременность проводят в день назначения препарата Роаккутан или за 3 дня до визита пациентки к врачу. Специалисту следует регистрировать результаты тестирования. Препарат может быть назначен только пациенткам, получающим эффективную контрацепцию не менее 1 месяца до начала терапии препаратом Роаккутан. Во время терапии: - Пациентка должна посещать врача каждые 28 дней. Необходимость ежемесячного тестирования на беременность определяется в соответствии с местной практикой и с учетом сексуальной активности, предшествующих нарушений менструального цикла. При наличии показаний тест на беременность проводится в день визита или за три дня до визита к врачу, результаты теста должны быть зарегистрированы. Окончание терапии: - Через 5 недель после окончания терапии проводится тест для исключения беременности. Рецепт на Роаккутан женщине, способной к деторождению, может быть выписан только на 30 дней лечения, продолжение терапии требует нового назначения препарата врачом. Рекомендуется тест на беременность, выписку рецепта и получение препарата проводить в один день. Выдачу препарата Роаккутан в аптеке следует осуществлять только в течение 7 дней с момента выписки рецепта. Чтобы помочь врачам, фармацевтам и больным избежать риска воздействия препарата Роаккутан на плод, компания-производитель создала "Программу предохранения от беременности", направленную на предупреждение о тератогенности препарата и подчеркивание абсолютно обязательного использования надежных мер контрацепции женщинами детородного возраста. Программа содержит следующие материалы: для врачей: - руководство для врача по назначению препарата Роаккутан женщинам - форму информированного согласия для пациентки - форма учета назначения препарата женщинам для пациента: - информационную брошюру для пациента - что нужно, знать о контрацепции - для фармацевта: - руководство для фармацевта по отпуску препарата Роаккутан. Полную информацию о тератогенном риске и строгом соблюдении мер по предотвращению беременности необходимо предоставлять как мужчинам, так и женщинам. Пациентам мужского пола. Существующие данные свидетельствуют о том, что у женщин экспозиция препарата, поступившего из семени и семенной жидкости мужчин, принимающих Роаккутан, не достаточна для появления тератогенных эффектов препарата Роаккутан. Мужчинам следует исключать возможность приема препарата другими лицами, особенно женщинами. Если, несмотря на принятые меры предосторожности, во время лечения препаратом Роаккутан или в течение месяца после его окончания беременность все же наступила, существует высокий риск очень тяжелых пороков развития плода (в частности, со стороны центральной нервной системы, сердца и крупных кровеносных сосудов). Кроме того, увеличивается риск самопроизвольных выкидышей. При возникновении беременности терапию препаратом Роаккутан прекращают. Следует обсудить целесообразность ее сохранения с врачом, специализирующимся на тератологии. Документально подтверждены тяжелые врожденные пороки развития плода у человека, связанные с назначением препарата Роаккутан, в том числе гидроцефалия, микроцефалия, пороки развития мозжечка, аномалии наружного уха (микротия, сужение или отсутствие наружного слухового прохода), микрофтальмия, сердечно-сосудистые аномалии (тетрада Фалло, транспозиция магистральных сосудов, дефекты перегородок), пороки развития лица (волчья пасть), вилочковой железы, патология паращитовидных желез. Поскольку изотретиноин обладает высокой липофильностью, весьма вероятно, что он попадает в грудное молоко. Из-за возможных побочных действий Роаккутан нельзя назначать кормящим матерям. Применение и дозы Стандартный режим дозирования Внутрь, во время еды один или два раза в день. Терапевтическая эффективность препарата Роаккутан и его побочные действия зависят от дозы и варьируют у разных больных. Это диктует необходимость индивидуального подбора дозы в ходе лечения. Лечение препаратом Роаккутан следует начинать с дозы 0.5 мг/кг в сутки. У большинства больных доза колеблется от 0.5 до 1.0 мг/кг массы тела в сутки. Больным с очень тяжелыми формами заболевания или с акне туловища могут потребоваться более высокие суточные дозы - до 2.0 мг/кг. Доказано, что частота ремиссии и профилактика рецидивов оптимальны при использовании курсовой дозы 120-150 мг/кг (на курс лечения), поэтому продолжительность терапии у конкретных больных меняется в зависимости от суточной дозы. Полной ремиссии акне часто удается добиться за 16-24 недели лечения. У больных, очень плохо переносящих рекомендованную дозу, лечение можно продолжить в меньшей дозе, однако проводить его дольше. У большинства больных акне полностью исчезают после однократного курса лечения. При явном рецидиве показан повторный курс лечения препаратом Роаккутан в той же суточной и курсовой дозе, как и первый. Поскольку улучшение может продолжаться вплоть до 8 недель после отмены препарата, повторный курс следует назначать не раньше окончания этого срока. Дозирование в особых случаях У больных с тяжелой почечной недостаточностью лечение следует начинать с меньшей дозы (например, 10 мг/сутки) и далее увеличивать до 1 мг/кг/сутки или максимально переносимой (но не более максимальной суточной дозы 1 мг/кг). Суточную дозу следует округлять в меньшую сторону до ближайшего меньшего количества целых капсул. Побочные эффекты и передозировка Побочные эффекты: Большинство побочных действий препарата Роаккутан зависят от дозы. Как правило, при назначении рекомендованных доз соотношение пользы и риска, учитывая тяжесть заболевания, приемлемо для больного. Обычно побочные действия носят обратимый характер после коррекции дозы или отмены препарата, но некоторые могут сохраняться после прекращения лечения. Симптомы, связанные с гипервитаминозом А: сухость кожи, слизистых оболочек, в т.ч. губ (хейлит), носовой полости (кровотечения), гортаноглотки (охриплость голоса), глаз (конъюнктивит, обратимое помутнение роговицы и непереносимость контактных линз). Кожа и ее придатки: сыпь, зуд, эритема лица/дерматит, потливость, пиогенная гранулема, паронихии, ониходистрофии, усиленное разрастание грануляционной ткани, стойкое истончение волос, обратимое выпадение волос, фульминантные формы акне, гирсутизм, гиперпигментация, фотосенсибилизация, фотоаллергия, легкая травмируемость кожи, шелушение кожи ладоней и подошв. В начале лечения может происходить обострение акне, сохраняющееся несколько недель. Костно-мышечная система: боли в мышцах с повышением активности креатинфосфоки- назы (КФК) в сыворотке или без него, боли в суставах, гиперостоз, артрит, обызвествление связок и сухожилий, уменьшение плотности костной ткани, преждевременное закрытие эпифизарных зон роста, другие изменения костей, тендиниты. Центральная нервная система и психическая сфера: нарушение поведения, депрессия, суицидальные попытки, суицид, психоз, чрезмерная утомляемость, головная боль, повышение внутричерепного давления ("псевдоопухоль головного мозга": головная боль, тошнота, рвота, нарушение зрения, отек зрительного нерва), судороги. Органы чувств: нарушение остроты зрения, светобоязнь, нарушение темновой адаптации (снижение остроты сумеречного зрения), нарушение цветовосприятия (проходящее после отмены препарата), лентикулярная катаракта, кератит, блефарит, конъюнктивит, раздражение глаз, ксерофтальмия, нарушение слуха на определенных звуковых частотах. Желудочно-кишечный тракт: тошнота, диарея, воспалительные заболевания кишечника (колит, илеит), кровотечения, сухость слизистой оболочки полости рта, кровотечение из десен, воспаление десен: панкреатит (особенно при сопутствующей гипертриглицеридемии выше 800 мг/дл), в том числе с фатальным исходом. Транзиторное и обратимое повышение активности печеночных трансаминаз, гепатит. Во многих этих случаях изменения не выходили за границы нормы и возвращались к исходным показателям в процессе лечения, однако в некоторых ситуациях возникала необходимость уменьшить дозу или отменить Роаккутан. Органы дыхания: бронхоспазм (чаще у больных с бронхиальной астмой в анамнезе). Система крови: анемия, снижение гематокрита, лейкопения, нейтропения,увеличение или уменьшение числа тромбоцитов, увеличение скорости оседания эритроцитов (СОЭ). Лабораторные показатели: гипертриглицеридемия, гиперхолестеринемия, гиперурикемия, снижение концентрации липопротеинов высокой плотности, гипергликемия. В ходе приема препарата Роаккутан были зарегистрированы случаи впервые выявленного сахарного диабета. У некоторых больных, особенно занимающихся интенсивной физической нагрузкой, описаны отдельные случаи повышения активности КФК в сыворотке. Иммунная система: местные или системные инфекции, вызванные грамположительными возбудителями (Staphylococcus aureus). Прочее: лимфаденопатия, гематурия, проте- инурия, васкулит (гранулематоз Вегенера, аллергический васкулит), системные реакции гиперчувствительности, гломерулонефрит, боль в спине. Постмаркетинговое наблюдение В ходе постмаркетингового наблюдения при применении препарата Роаккутан описаны случаи развития тяжелых кожных реакций, таких как мультиформная эритема, синдром Стивенса-Джонсона, токсический эпидермальный некролиз (см. также раздел "Особые указания"). При применении препарата Роаккутан, особенно у пациентов, совершавших интенсивные физические нагрузки, сообщалось о серьезных случаях рабдомиолиза, часто приводивших к госпитализации и в некоторых случаях - к фатальному исходу. Передозировка: В случае передозировки могут появиться признаки гипервитаминоза А. В первые несколько часов после передозировки может понадобиться промывание желудка. Взаимодействие с другими ЛС: Из-за возможного усиления симптомов гипервитаминоза А следует избегать одновременного назначения препарата Роаккутан и витамина А (ретинола), а также других пероральных ретиноидов. Поскольку тетрациклины также могут вызвать повышение внутричерепного давления, их применение в сочетании с препаратом Роаккутан противопоказано. Изотретиноин может ослабить эффективность препаратов прогестерона, поэтому не следует пользоваться контрацептивными средствами, содержащими малые дозы прогестерона. Сочетанное применение с местными кератолитическими или эксфолиативными препаратами для лечения акне противопоказано из-за возможного усиления местного раздражения. Фармакологическое действие и фармакокинетика Ретиноид для системной терапии угревой болезни Изотретиноин - стереоизомер полностью транс-ретиноевой кислоты (третиноина). Точный механизм действия препарата Роаккутан еще не выяснен, однако установлено, что улучшение клинической картины тяжелых форм акне связано с подавлением активности сальных желез и гистологически подтвержденным уменьшением их размеров. Кроме того, доказано противовоспалительное действие изотретиноина на кожу. Гиперкератоз клеток эпителия волосяной луковицы и сальной железы приводит к слущиванию корнеоцитов в проток железы и к закупорке последнего кератином и избытком сального секрета. За этим следует образование комедона и, в ряде случаев, присоединение воспалительного процесса. Роаккутан подавляет пролиферацию себоцитов и действует на акне, восстанавливая нормальный процесс дифференцировки клеток. Кожное сало - основной субстрат для роста Propionibacterium acnes, поэтому уменьшение образования кожного сала подавляет бактериальную колонизацию протока. Фармакокинетика: Поскольку кинетика изотретиноина и его метаболитов носит линейный характер, его концентрации в плазме в ходе терапии можно предсказать на основании данных, полученных после разового приема. Это свойство препарата также говорит о том, что он не влияет на активность печеночных ферментов, участвующих в метаболизме лекарственных средств. Всасывание Всасывание изотретиноина из желудочно-кишечного тракта колеблется. Абсолютная биодоступность изотретиноина не определялась, поскольку формы выпуска препарата для внутривенного применения у человека нет. Однако экстраполирование данных, полученных в эксперименте на собаках, позволяет предполагать довольно низкую и вариабельную системную биодоступность. У больных с акне максимальные концентрации в плазме (Смакс) в равновесном состоянии после приема 80 мг изотретиноина натощак составляли 310 нг/мл (диапазон 188-473 нг/мл) и достигались через 2-4 часа. Концентрации изотретиноина в плазме примерно в 1.7 раз выше концентраций в крови, вследствие плохого проникновения изотретиноина в эритроциты. Прием изотретиноина с пищей увеличивает биодоступность в 2 раза по сравнению с приемом натощак. Распределение Изотретиноин в сильной степени (99.9%) связывается с белками плазмы, главным образом с альбуминами, так что в широком диапазоне терапевтических концентраций содержание свободной (фармакологически активной) фракции препарата составляет менее 0.1% его общего количества. Объем распределения изотретиноина у человека не определялся, поскольку лекарственной формы для внутривенного введения не существует. Равновесные концентрации изотретиноина в крови (Смин ss) У больных с тяжелыми акне, принимавших по 40 мг препарата 2 раза в сутки, колебались от 120 до 200 нг/мл. Концентрации 4-оксо-изотретиноина у этих больных в 2.5 раза превышали таковые изотретиноина. Данных о проникновении изотретиноина в ткани у человека недостаточно. Концентрации изотретиноина в эпидермисе в два раза ниже, чем в сыворотке. Метаболизм После приема внутрь в плазме обнаруживаются три основных метаболита: 4-оксо- изотретиноин, третиноин (полностью транс-ретиноевая кислота) и 4-оксо-ретиноин. Главным метаболитом является 4-оксо-изотретиноин, плазменные концентрации которого в равновесном состоянии в 2.5 раза выше, чем концентрации исходного препарата: Обнаружены и менее значимые метаболиты, включающие также глюкурониды, однако установлена структура не всех метаболитов. Метаболиты изотретиноина обладают биологической активностью, подтвержденной в нескольких лабораторных тестах. Таким образом, клинические эффекты препарата у больных могут быть результатом фармакологической активности изотретиноина и его метаболитов. Поскольку in vivo изотретиноин и третиноин (полностью транс-ретиноевая кислота) обратимо превращаются друг в друга, метаболизм третиноина связан с метаболизмом изотретиноина. 20-30% дозы изотретиноина метаболизируется путем изомеризации. В фармакокинетике изотретиноина у человека существенную роль может играть энтерогепатическая циркуляция. Исследования метаболизма in vitro показали, что в превращении изотретиноина в 4-оксо- изотретиноин и третиноин участвуют несколько ферментов системы цитохрома Р450 (CYP). По-видимому, ни одна из изоформ при этом не играет доминирующей роли. Роаккутан и его метаболиты не оказывают существенного влияния на активность ферментов системы CYP. Выведение После приема внутрь радиоактивно меченного изотретиноина в моче и кале обнаруживается примерно одинаковое количество. Период полувыведения терминальной фазы для неизмененного препарата у больных с акне составляет в среднем 19 часов. Период полувыведения терминальной фазы для 4-оксо-изотретиноина, по-видимому, больше и равняется в среднем 29 часам. Изотретиноин относится к природным (физиологическим) ретиноидам. Эндогенные концентрации ретиноидов восстанавливаются примерно через 2 недели после окончания приема препарата Роаккутан. Фармакокинетика в особых клинических случаях Поскольку изотретиноин противопоказан при нарушении функции печени, данные о фармакокинетике препарата у этой группы больных ограничены. Почечная недостаточность не влияет на фармакокинетику изотретиноина. Особые указания Роаккутан должны назначать только врачи, предпочтительно дерматологи, имеющие опыт применения системных ретиноидов и знающие о риске тератогенности препарата. Пациентам как женского, так и мужского пола необходимо выдавать копию брошюры с информацией для пациента. Во избежание случайного воздействия препарата на организм других людей, у больных, которые получают или незадолго до этого (1 месяц) получали Роаккутан, нельзя брать донорскую кровь. Рекомендуется контролировать функцию печени и печеночные ферменты до лечения, через 1 месяц после его начала, а затем каждые 3 месяца или по показаниям. Отмечено преходящее и обратимое увеличение печеночных трансаминаз, в большинстве случаев в пределах.нор-мальных значений. Если активность печеночных трансаминаз превышает норму, необходимо уменьшить дозу препарата или отменить его. Следует определять также концентрацию липидов в сыворотке натощак до лечения, через 1 месяц после начала, а затем каждые 3 месяца или по показаниям. Обычно концентрации липидов нормализуются после уменьшения дозы или отмены препарата, а также при соблюдении диеты. Необходимо контролировать клинически значимое повышение концентрации триглицеридов, поскольку их подъем свыше 800 мг/дл или 9 ммоль/л может сопровождаться развитием острого панкреатита, возможно с летальным исходом. При стойкой гипертриглицеридемии или симптомах панкреатита Роаккутан следует отменить. В редких случаях у больных, получавших Роаккутан, описаны депрессия, психотическая симптоматика и очень редко - суицидальные попытки и суицид. Хотя их причинная связь с применением препарата не установлена, необходимо соблюдать особую осторожность у больных с депрессией в анамнезе и наблюдать всех пациентов на предмет возникновения депрессии в ходе лечения препаратом, при необходимости направляя их к соответствующему специалисту. Однако отмена препарата Роаккутан может не приводить к исчезновению симптомов и может потребоваться дальнейшее наблюдение и лечение у специалиста.В редких случаях в начале терапии отмечается обострение акне, которое проходит в течение 7-10 дней без коррекции дозы препарата. Через несколько лет после применения препарата Роаккутан для лечения дискератозов при общей курсовой дозе и продолжительности терапии, выше рекомендованных для терапии акне, развивались костные изменения, в том числе преждевременное закрытие эпифизарных зон роста, гиперостоз, кальцификация связок и сухожилий. Поэтому при назначении препарата любому больному, следует предварительно тщательно оценить соотношение возможной пользы и риска. Пациентам, получающим Роаккутан, рекомендуется использовать увлажняющие мазь или крем для тела, бальзам для губ для уменьшения сухости кожи и слизистых в начале терапии. В ходе постмаркетингового наблюдения при применении препарата Роаккутан описаны случаи развития тяжелых кожных реакций, таких как мультиформная эритема, синдром Стивенса-Джонсона, токсический эпидермальный некролиз. Данные явления могут носить серьезный характер и привести к потере трудоспособности, угрожающим жизни состояниям, госпитализации или фатальному исходу. Пациенты, получающие Роаккутан, нуждаются в тщательном наблюдении с целью выявления тяжелых кожных реакций и при необходимости решения вопроса об отмене препарата. На фоне приема препарата Роаккутан возможны боли в мышцах и суставах, увеличение активности КФК сыворотки крови, которые могут сопровождаться снижением переносимости интенсивной физической нагрузки. Следует избегать проведения глубокой химической дермоабразии и лечения лазером у больных, получающих Роаккутан, а также в течение 5-6 месяцев после окончания лечения из-за возможности усиленного рубцевания в атипичных местах и (реже) возникновения гипер- и гипопигментации. В ходе лечения препаратом Роаккутан и в течение 6 месяцев после него нельзя проводить эпиляцию с помощью аппликаций воска из-за риска отслойки эпидермиса, развития рубцов и дерматита. Поскольку у некоторых больных может наблюдаться снижение остроты сумеречного зрения, которое иногда сохраняется и после окончания терапии, больных следует информировать о возможности этого состояния, рекомендуя им соблюдать осторожность при вождении автомобиля в ночное время. Состояние остроты зрения нужно тщательно контролировать. Сухость конъюнктивы глаз, помутнения роговицы, ухудшение сумеречного зрения и кератит обычно проходят после отмены препарата. При сухости слизистой оболочки глаз можно использовать аппликации увлажняющей глазной мази или препарата искусственной слезы. Необходимо наблюдать больных с сухостью конъюнктивы на предмет возможного развития кератита. Больных, предъявляющих жалобы на зрение, следует направлять к офтальмологу и рассмотреть вопрос о целесообразности отмены препарата Роаккутан. При непереносимости контактных линз на время терапии следует использовать очки. Следует ограничивать воздействие солнечных и ультрафиолетовых лучей. При необходимости следует использовать солнцезащитный крем с высоким значением защитного фактора не менее 15 SPF (sun protection factor). Описаны редкие случаи развития доброкачественной внутричерепной гипертензии ("псевдоопухоль головного мозга"), в т.ч. при сочетанном применении с тетрациклинами. У таких пациентов следует немедленно отменить Роаккутан. При терапии препаратом Роаккутан возможно возникновение воспалительного заболевания кишечника. У больных с выраженной геморрагической диареей необходимо немедленно отменить Роаккутан. Описаны редкие случаи анафилактических реакций, которые возникали только после предшествующего наружного применения ретиноидов. Тяжелые аллергические реакции диктуют необходимость отмены препарата и тщательного наблюдения за больным. Больным из группы высокого риска (с сахарным диабетом, ожирением, хроническим алкоголизмом или нарушениями жирового обмена) при лечении препаратом Роаккутан может потребоваться более частый лабораторный контроль концентрации глюкозы и липидов. При наличии диабета или подозрении на него рекомендуется более частое определение гликемии. Попадание лекарственных препаратов в окружающую среду должно быть сведено к минимуму. Не допускается утилизация препарата Роаккутан с помощью сточных вод или вместе с бытовыми отходами. По возможности необходимо использовать специальные системы для утилизации лекарственных препаратов. Влияние на способность управлять транспортными средствами: В период лечения необходимо соблюдать крайнюю осторожность при управлении транспортными средствами и занятии другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций. Поскольку у некоторых больных может наблюдаться снижение остроты сумеречного зрения, которое иногда сохраняется и после окончания терапии, больных следует информировать о возможности этого состояния, рекомендуя им соблюдать осторожность при вождении автомобиля и работе с машинами и механизмами в ночное время. Условия хранения и отпуска из аптек Условия хранения:Хранить при температуре не выше 25°С в защищенном от света и влаги месте. Хранить в недоступном для детей месте. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Роаккутан Международное непатентованное название:Изотретиноин. Форма выпуска:капсулы. Состав:Одна капсула 10 мг содержит: действующее вещество: изотретиноин - 10 мг: вспомогательные вещества: соевых бобов масло - 107.92 мг, воск пчелиный желтый - 7.68 мг, соевых бобов масло гидрогенизированное - 7.68 мг, соевых бобов масло частично гидрогенизированное - 30.72 мг: оболочка капсулы: глицерол 85% - 31.275 мг, желатин - 75.64 мг, Карион 83 (крахмал картофельный гидролизованный, маннитол, сорбитол) - 8.065 мг, краситель железа оксид красный (Е172) - 0.185 мг, титана диоксид (Е171)-1.185 мг: чернила для нанесения надписи на капсуле: шеллак, краситель железа оксид черный (Е172): допускается использование готовых чернил Opacode Black S-1-17823. Одна капсула 20 мг содержит: действующее вещество: изотретиноин - 20 мг: вспомогательные вещества: соевых бобов масло - 215.84 мг, воск пчелиный желтый - 15.36 мг, соевых бобов масло гидрогенизированное - 15.36 мг, соевых бобов масло частично гидрогенизированное - 61.44 мг: оболочка капсулы: глицерол 85% - 49.835 мг, желатин - 120.66 мг, Карион 83 (крахмал картофельный гидролизованный, маннитол, сорбитол) - 12.86 мг, краситель железа оксид красный (Е172) - 0.145 мг, титана диоксид (Е171) - 1.97 мг: чернила для нанесения надписи на капсуле: шеллак, краситель железа оксид черный (Е172): допускается использование готовых чернил Opacode Black S-l-17823. АТХ: Регистрация: Лекарственное средство П N013958/01 Фармгруппа: Средство лечения угревой сыпи. Дата регистрации: 01.10.2007. Окончание регстрации: . Описание:Капсулы 10мг: капсулы овальной формы, коричнево-красного цвета, непрозрачные: на поверхности капсулы надпись черными чернилами "ROA 10": содержимое капсулы - однородная суспензия от желтого до темно-желтого цвета. Капсулы 20 мг: капсулы овальной формы, одна половина коричнево-красного цвета, непрозрачная, другая половина белая, непрозрачная: на поверхности капсулы надпись черными чернилами "ROA 20": содержимое капсулы - однородная суспензия от желтого до темно- желтого цвета. Упаковка:Капсулы 10 мг и 20 мг. По 10 капсул в блистер ПВХ/ПЭ/ПВДХ/А1 или ПВХ/ПВДХ/А1 или ПВХ/А1. 3 или 10 блистеров вместе с инструкцией по применению помещают в картонную пачку. Срок годности:3 года. Препарат не следует использовать по истечении срока годности, указанного на упаковке. Владелец рег.удостоверения:Хоффманн-Ля Рош Лтд. Производитель:F. Hoffmann-La Roche, Ltd. Представительство:Ф. Хоффманн-Ля Рош Лтд
1696 Руб.Ультракаин Д-С р-р д/ин. 2мл №10
Латинское названиеULTRACAIN® DМеждународное непатентованное названиеартикаин+эпинефрин. Форма выпуска. Раствор для инъекций. Упаковка 10 амп. по 2 мл. 10 шт. Описание. Раствор для инъекций прозрачный, бесцветный. Фармакологическое действие. Комбинированный местноанестезирующий препарат, в состав которого входит артикаин (местноанестезирующее средство амидного типа) и эпинефрин (сосудосуживающее средство), которое добавляется в состав препарата для пролонгирования продолжительности анестезии. Амидная структура артикаина подобна структуре других местноанестезирующих средств, но в его молекуле содержится одна дополнительная эфирная группа, которая в организме человека быстро гидролизуется эстеразами. С быстрым разрушением артикаина до его неактивного метаболита (артикаиновой кислоты) связана очень низкая системная токсичность препарата, позволяющая проводить повторные инъекции препарата. Местноанестезирующие средства вызывают обратимую потерю чувствительности вследствие прекращения или уменьшения проводимости сенсорных нервных импульсов непосредственно в месте инъекции и вокруг него. Они обладают мембраностабилизирующим эффектом за счет снижения проницаемости мембран нервных клеток для ионов натрия. Препарат оказывает быстрое (латентный период - от 1 до 3 мин) и сильное анестезирующее действие и имеет хорошую тканевую переносимость. Продолжительность анестезии составляет не менее 75 мин. Фармакокинетика Всасывание После подслизистого введения 2 мл препарата Тmахартикаина вплазмекрови составляет 10-15 мин, а среднее значение в плазме крови Сmаxартикаина составляет приблизительно 400 мкг/л, Тmахартикаиновой кислоты составляет 45 мин, а среднее значение Сmахартикаиновой кислоты составляет 2000 мкг/л. У детей были получены сопоставимые фармакокинетические данные. Различия между плазменными концентрациями артикаина и артикаиновой кислоты отражают быстрый гидролиз артикаина в тканях и крови, так что введенный артикаин поступает в системный кровоток в основном в виде неактивного метаболита. Распределение После подслизистого введения концентрации артикаина в крови в области зубных альвеол в тысячи раз превышает концентрации артикаина в системном кровотоке. Выявлена обратная связь между временем после инъекции и концентрацией артикаина в альвеоле зуба. Связывание артикаина с белками плазмы составляет 95%. Метаболизм Все местноанестезирующие средства амидного типа метаболизируются в микросомах печени. Кроме этого артикаин в тканях и крови еще инактивируется неспецифическими плазменными эстеразами путем гидролиза в карбоксильной группе. Т.к. гидролиз происходит очень быстро и начинается сразу после введения, около 90% артикаина инактивируется этим способом. Образующийся в результате главный метаболит артикаина - артикаиновая кислота - не обладает местноанестезирующей активностью, и у него не выявлено системной токсичности. Выведение После подслизистого введения выведение артикаина происходит экспоненциально с T1/2приблизительно 25 мин. Артикаин выводится главным образом почками в виде артикаиновой кислоты (64.214.4%), глюкуронида артикаиновой кислоты (13.45%) и неизмененного артикаина (1.450.77%). После инъекций препарата в слизистую полости рта общий клиренс артикаина составляет 23527 л/ч. Аналоги по составу Санофи-Авентис, Франция. Раствор 4980 руб. Показания. Инфильтрационная и проводниковая анестезия при стоматологических операциях: неосложненные удаления одного или нескольких зубов. обработка кариозных полостей зуба. обтачивание зубов перед протезированием. Способ применения и дозы. Препарат предназначен для применения в ротовой полости и может вводиться только в ткани, где отсутствует воспаление. Нельзя проводить инъекцию в воспаленные ткани. Препарат нельзя вводить в/в. Для анестезии при неосложненном удалении зубов верхней челюсти при отсутствии воспаленияобычно достаточно создания депо препарата Ультракаин Д-С (Ультракаин Д-С форте) в области переходной складки путем его введения в подслизистую с вестибулярной стороны - по 1.7 мл препарата на зуб. В редких случаях для достижения полной анестезии может потребоваться дополнительное введение от 1 мл до 1.7 мл. В большинстве случаев это позволяет не проводить болезненной небной инъекции. При удалении нескольких рядом расположенных зубов количество инъекций обычно удается ограничить. Для анестезии при разрезах и наложении швов в области неба с целью создания небного депонеобходимо около 0.1 мл препарата на каждую инъекцию. В случае удаления премоляров нижней челюсти при отсутствии воспаленияможно обойтись без мандибулярной анестезии, т.к. обычно достаточной является инфильтрационная анестезия, обеспечиваемая инъекцией 1.7 мл препарата на зуб. Если же таким путем не удалось достичь желаемого эффекта, следует выполнить дополнительную инъекцию 1-1.7 мл препарата в подслизистую в области переходной складки нижней челюсти с вестибулярной стороны. Если же и в этом случае не удалось достичь полной анестезии, необходимо провести проводниковую блокаду нижнечелюстного нерва. При хирургических вмешательствах доза препарата. Ультракаин Д-Сфорте в зависимости от тяжести и длительности вмешательства устанавливается индивидуально. При выполнении одной лечебной процедурывзрослымможно вводить артикаин в дозе до 7 мг на 1 кг массы тела. Отмечено, что пациенты хорошо переносили дозы до 500 мг (соответствует 12.5 мл раствора для инъекций). Удетей старше 4 летдозу препарата подбирают в зависимости от возраста и массы тела ребенка; доза не должна превышать 5 мг артикаина на 1 кг массы тела. Упациентов пожилого возрастаипациентов с тяжелой почечной и печеночной недостаточностьювозможно создание повышенных плазменных концентраций артикаина. У этих пациентов препарат следует применять в минимальной дозе, необходимой для достижения достаточной глубины анестезии. Для того чтобы избежать случайного внутрисосудистого введения препарата, всегда перед его введением следует проводить аспирационную пробу. Давление инъекции должно соответствовать чувствительности тканей. Состав 1 млартикаина гидрохлорид 40 мгэпинефрина гидрохлорид 12 мкг, эквивалентно содержанию основания эпинефрина 10 мкг, что соответствует содержанию эпинефрина в растворе 1:100 000. Вспомогательные вещества: натрия дисульфит (натрия метабисульфит), натрия хлорид, вода д/и. Противопоказания. Тяжелые нарушения функции синусового узла или тяжелые нарушения проводимости (такие как выраженная брадикардия, AV-блокада II-III степени). острая декомпенсированная сердечная недостаточность. тяжелая артериальная гипотензия. анемия (в том числе В 12-дефицитная анемия). метгемоглобинемия. гипоксия. детский возраст до 4 лет (отсутствие клинического опыта). повышенная чувствительность к компонентам препарата. повышенная чувствительность к другим местноанестезирующим средствам амидного типа, за исключением случаев, когда при гиперчувствительности к данным средствам аллергия к артикаину была исключена с помощью соответствующих исследований, проведенных с соблюдением всех необходимых правил и требований. С осторожностьюследует применять препарат при недостаточности холинэстеразы (применяют только в случае крайней необходимости, так как возможно пролонгированное и чрезмерно сильное действие препарата). Применение при беременности и кормлении грудью. Артикаин проникает через плацентарный барьер. Ввиду недостаточности клинических данных решение о назначении препарата врачом - стоматологом может быть принято только в том случае, если потенциальная польза от его применения оправдывает потенциальный риск для плода. В период лактации нет необходимости прерывать грудное вскармливание, так как в грудном молоке не обнаруживается клинически значимых концентраций артикаина, однако с целью предосторожности грудное вскармливание следует прерывать на 4 ч после введения последней дозы артикаина. Особые указания. Влияние на способность к вождению автотранспорта и управлению механизмами: решение о том, когда пациент после стоматологического вмешательства сможет вернуться к вождению автотранспорта и занятиям потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций, должен принимать врач. Во избежание внутрисосудистого введения необходимо всегда проводить аспирационный тест. Для предотвращения занесения инфекций (в том числе, вирусного гепатита) необходимо следить за тем, чтобы при заборе раствора из ампул всегда использовались новые стерильные шприцы и иглы. Открытые картриджи нельзя использовать снова для других пациентов. Нельзя использовать для инъекций поврежденный картридж. Пациентам требуется наблюдение за состоянием сердечно-сосудистой системы, дыхательной системы, ЦНС. Принимать пищу можно лишь после прекращения действия местной анестезии (восстановления чувствительности). Побочные эффекты. Со стороны ЦНС:дозозависимые реакции - ступор, иногда прогрессирующий до потери сознания, дыхательные расстройства, иногда прогрессирующие до остановки дыхания, мышечный тремор, мышечные подергивания иногда прогрессирующие до генерализованных судорог; возможны - головокружение, парестезия, гипестезия, преходящие зрительные расстройства (нечеткость зрительного восприятия, слепота, двоение в глазах), возникающие во время или через короткое время после инъекции местноанестезирующего средства. Иногда при нарушении правильной техники инъекции при введении местноанестезирующего средства в стоматологической практике возможно повреждение нерва, в частности, в таких случаях возможно повреждение лицевого нерва, которое может привести к развитию паралича лицевого нерва. Часто - головная боль, главным образом, вследствие наличия в составе препарата эпинефрина. Со стороны пищеварительной системы:тошнота, рвота. Со стороны сердечно-сосудистой системы:снижение АД, брадикардия, сердечная недостаточность, шок. Очень редко вследствие содержания в составе препарата эпинефрина возможно развитие тахикардии, нарушений сердечного ритма, повышение АД. Аллергические реакции:возможны - гиперемия кожных покровов, конъюнктивит, ринит и ангионевротический отек. Ангионевротический отек может проявляться отеком верхней и/или нижней губ, щек, отеком голосовых связок с ощущением комка в горле и затруднениями глотания, крапивница, затруднение дыхания. Любые из этих проявлений могут прогрессировать до анафилактического шока. Местные реакции:отечность или воспаление слизистой оболочки в месте инъекции. В отдельных случаях при случайном внутрисосудистом введении возможно появление зон ишемии в месте введения, вплоть до некроза тканей. Лекарственное взаимодействие. Противопоказанные комбинации Противопоказана комбинация с кардионеселективными бета-адреноблокаторами, например, пропранололом, т.к. имеется риск развития гипертонического криза и выраженной брадикардии. Взаимодействия, которые следует принимать во внимание Возможно усиление действия вазоконстрикторов, повышающих АД, таких как эпинефрин, при одновременном применении трициклических антидепрессантов или ингибиторов МАО. Подобные наблюдения были описаны для концентраций норэпинефрина 1:25 000 и эпинефрина 1:80 000 при их применении в качестве вазоконстрикторов. Концентрация эпинефрина в препарате Ультракаин Д-С форте ниже - 1:100 000. Однако учитывать возможности такого усиления действия необходимо. Местноанестезирующие средства усиливают действие лекарственных средств, угнетающих ЦНС. Опиоидные анальгетики усиливают действие местноанестезирующих средств, однако повышают риск угнетения дыхания. При проведении инъекций препарата Ультракаин Д-С форте пациентам, получающим гепарин илиацетилсалициловую кислоту, возможно развитие кровотечений в месте инъекции. Ультракаин Д-С форте увеличивает интенсивность и длительность действия миорелаксантов. Ультракаин Д-С форте проявляет антагонизм в отношении воздействия на склелетную мускулатруру с препаратами для лечения миастении, поэтому при его применении, особенно в высоких дозах, требуется дополнительная коррекция лечения миастении. Ультракаин Д-С форте вызывает замедление метаболизма местноанестезирующих лекарственных средств. При одновременном применении с ингибиторами холинэстеразы происходит замедление метаболизма местноанестезирующих лекарственных средств. Эпинефрин способен ингибировать высвобождение инсулина из бета-клеток поджелудочной железы и уменьшать эффекты гипогликемических средств для приема внутрь. Галотан может повышать чувствительность сердца к катехоламинам и поэтому повышать риск развития нарушений сердечного ритма после инъекций препарата Ультракаин Д-С форте. При обработке места инъекции местного анестетика дезинфицирующими растворами, содержащими тяжелые металлы, повышается риск развития местных реакций - отека, болезненности. Условия хранения. Препарат следует хранить в защищенном от света месте при температуре не выше 25
2799 Руб.Флюкостат капс. 50мг №7

Показания криптококкоз, включая криптококковый менингит и другие локализации данной инфекции (в т.ч. легкие, кожа), как у больных с нормальным иммунным ответом, так и у больных с различными формами иммуносупрессии (в т. ч. у больных СПИД, при трансплантации органов): препарат может использоваться для профилактики криптококковой инфекции у больных СПИДом:в генерализованный кандидоз, включая кандидемию, диссеминированный кандидоз и другие формы инвазивных кандидозных инфекций (инфекции брюшины, эндокарда, глаз, дыхательных и мочевых путей). Лечение может проводиться у больных со злокачественными новообразованиями, больных отделений интенсивной терапии, больных, проходящих курс цитостатической или иммуносупрессивной терапии, а также при наличии других факторов, предрасполагающих к развитию кандидоза: в кандидоз слизистых оболочек, в т.ч. полости рта и глотки (в т.ч. атрофический кандидоз полости рта, связанный с ношением зубных протезов), пищевода, неинвазивные бронхолегочные кандидозы, кандидурия, кандидозы кожи: профилактика рецидива орофарингеального кандидоза у больных СПИД: генитальный кандидоз: лечение вагинального кандидоза (острого и хронического рецидивирующего), профилактическое применение с целью уменьшения частоты рецидивов вагинального кандидоза (3 и более эпизодов в год): кандидозный баланит: профилактика грибковых инфекций у больных со злокачественными новообразованиями, которые предрасположены к таким инфекциям в результате химиотерапии цитостатиками или лучевой терапии:микозы кожи, включая микозы стоп, тела, паховой области: отрубевидный лишай, онихомикоз: кандидоз кожи:в глубокие эндемические микозы, включая кокцидиомикоз, паракокцидиомикоз, споротрихоз и гистоплазмоз у больных с нормальным иммунитетом. Противопоказания Противопоказания Одновременный прием терфенадина (на фоне многократного приема флуконазола в дозе 400 мг/сут и более) (см. раздел "Взаимодействие с другими лекарственными средствами"):Повышенная чувствительность к флуконазолу и другим компонентам препарата или близким по структуре азольным соединениям:Детский возраст до 3-х лет (для данной лекарственной формы):Период лактации (см. раздел "Применение при беременности и в период грудного вскармливания"):Одновременное применение с препаратами, увеличивающими интервал Q-Tиметаболизирующимися с помощью изоферменга CY3A4, такими как цизаприд, астемизол, эритромицин, пимозид и хинидин (см. раздел "Взаимодействие с другими лекарственными средствами"):Непереносимость лактозы, дефицит лактазы, глюкозо-галактозная мальабсорбция С осторожностью: - Нарушение показателей функции печени- Одновременный прием потенциально гепатотоксичных лекарственных средств- Алкоголизм- Проаритмогеиные состояния у пациентов с множественными факторами риска (органические заболевания сердца, нарушения электролитного баланса, одновременный прием лекарственных средств, вызывающих аритмии)- Нарушение функции почек- Появление сыпи на фоне применения флуконазола у больных с поверхностной грибковой инфекцией и инвазивными/системными грибковыми инфекциями- Одновременное применение терфеиадина и флуконазола в дозе менее 400 мг/сут. Беременность Адекватных и контролируемых исследований применения флукопазола у беременных женщин нс проводилось.В настоящее время нет доказательств влияния низких доз флукопазола (150 мг однократно для лечения вульвовагинального кан- дидоза) на повышение частоты неблагоприятных исходов беременности, а также взаимосвязи с возникновением каких-либо специфических пороков развития у ребенка. При применении высоких доз (400- 800 мг/сут) флукопазола описано несколько случаев множественных врожденных пороков у новорожденных, матери которых на протяжении большей части или всего первого триместра получали терапию флуконазолом. Применение препарата у беременных нецелесообразно, за исключением тяжелых или угрожающих жизни форм грибковых инфекций, если предполагаемая польза для матери превышает возможный риск для плода. Женщинам детородного возраста следует использовать средства контрацепции. Флуконазол находится в грудном молоке в такой же концентрации, как и в плазме, поэтому его назначение в период лактации противопоказано. Применение и дозы Внутрь. Взрослым при криптококковом менингите и криптококковых инфекциях других локализаций в первый день обычно назначают 400 мг (8 капсул по 50 мг), а затем продолжают лечение в дозе 200-400 мг 1 раз/сут. Продолжительность лечения при криптококковых инфекциях зависит от клинической эффективности, подтвержденной микологическим исследованием: при криптококковом менингите его обычно продолжают по крайней мере 6-8 недель. Для профилактики рецидива криптококкового менингита у больных СПИД, после завершения полного курса первичного лечения, флуконазол назначают в дозе 200 мг/сут в течение длительного периода времени. При кандидемии, диссеминированном кандидозе и других инвазивных кандидозных инфекциях доза обычно составляет 400 мг в первые сутки, а затем - по 200 мг. При недостаточной клинической эффективности доза препарата может быть увеличена до 400 мг/сут. Длительность терапии зависит от клинической эффективности. При орофарингеальном кандидозе препарат обычно назначают по 50-100 мг 1 раз/сут: продолжительность лечения - 7- 14 дней. При необходимости, у больных с выраженным снижением иммунитета лечение может быть более длительным. При атрофическом кандидозе полости рта, связанном с ношением зубных протезов, флуконазол обычно назначают по 50 мг 1 раз/сут в течение 14 дней в сочетании с местными антисептическими средствами для обработки протеза. При других локализациях кандидоза (за исключением генитального кандидоза), например при эзофагите, неинвазивном бронхолегочном поражении, кандидурии, кандидозе кожи и слизистых оболочек и т.д, эффективная доза обычно составляет 50-100 мг/сут при длительности лечения 14-30 дней. Для профилактики рецидивов орофарингеального кандидоза у больных со СПИД после завершения полного курса первичной терапии препарат может бьггь назначен по 150 мг 1 раз в неделю. При вагинальном кандидозе флуконазол принимают: ТАБЛИЦЪНекоторым больным может потребоваться более частое применение . При баланите вызванном Candida, флуконазол назначают однократно в дозе 150 мг внутрь. Побочные эффекты и передозировка Побочные эффекты: Со стороны желудочно-кишечного тракта: сухость слизистой оболочки полости рта, рвота, тошнота, диарея, запор, метеоризм, абдоминальные боли,Со стороны печени и желчевыводящих путей: редко - нарушение функции печени (желтуха, гепатит, гепатонекроз, гипербилирубипемия, повышение активности аланинаминотрансфсразы, аспартатаминотрансферазы, щелочной фосфатазы), гепатотоксичность, в некоторых случаях с летальным исходом, холесгаз, генатоцеллюлярное повреждение. Со стороны нервной системы: головная боль, головокружение, изменение вкуса, парестезия. бессонница, сонливость, тремор: редко - судороги. Со стороны кроен и лимфатической системы: анемия: редко - лейкопения, тромбоцитопения, иейтропения, агранулоцитоз. Со стороны сердечно-сосудистой системы: увеличение продолжительности интервала Q-T: мерцание, трепетание желудочков, аритмия желудочковая тахисистолическая типа "пируэт" (torsade de pointes). Со стороны кожных покровов: сыпь, алопеция, эксфолиативпые поражения кожи, включая синдром Стивенса-Джонсона и токсический эпидермальный некролиз, острый генерализованный экзантематозный пустулез, повышенное потоотделение, лекарственная сыпь. Со стороны обмена веществ: повышение концентрации холестерина и триглицеридов в плазме крови, гипокалиемия. Со стороны опорно-двигательного аппарата миалгия. Прочие: слабость, астения, повышенная утомляемость, лихорадка, повышенная потливость, вертиго: редко - нарушение функции почек. Передозировка: Симптомы: галлюцинации, параноидальное поведение. Лечение: симптоматическое, промывание желудка, форсированный диурез. Гемодиализ в течение 3 ч снижает концентрацию в плазме приблизительно на 50%. Взаимодействие с другими ЛС: Однократный или многократный прием флуконазола в дозе 50 мг не влияет на метаболизм феназона (Антипирина) при их одновременном приеме. Одновременное применение флуконазола со следующими препаратами противопоказано. Цизаприд. При одновременном применении флуконазола и цизаприда возможны нежелательные реакции со стороны сердца, в т. ч. аритмия желудочковая тахисистолическая типа "пируэт" (torsade dc pointes). Применение флуконазола в дозе 200 мг 1 раз в сутки и цизаприда в дозе 20 мг 4 раза в сутки приводит к выраженному увеличению плазменных концентраций цизаприда и увеличению интервала Q-T на ЭКГ. Терфенадин. При одновременном применении азольных противогрибковых средств и терфинадина возможно возникновение серьезных аритмий в результате увеличения интервала Q-T. При приеме флуконазола в дозе 200 мг/сут увеличения интервала Q-T не установлено. Однако применение флуконазола в дозах 400 мг/сут и выше вызывает значительное увеличение концентрации терфенадина в плазме крови. Одновременный прием флуконазола в дозах 400 мг/сут и более с терфенадином противопоказан (см. раздел "Противопоказания"). Лечение флуконазолом в дозах менее 400 мг/сут в сочетании с терфенадином следует проводить под тщательным контролем. Астемизол. Одновременное примене- ние флуконазола с астемизолом или другими препаратами, метаболизм которых осуществляется системой цитохрома Р450, может сопровождаться повышением сывороточных концентраций этих средств. Повышенные концентрации астемизола в плазме крови могут приводить к удлинению интервала Q-T и в некоторых случаях к развитию аритмии желудочковой тахисистолической типа "пируэт" (torsade dc pointes). Одновременное применение астемизола и флуконазола противопоказано. Пимозид. Несмотря па то, что не проводилось соответствующих исследований in vitro или in vivo, одновременное применение флуконазола и пимозида может приводить к угнетению метаболизма пимозида. В свою очередь повышение плазменных концентраций пимозида может приводить к удлинению интервала Q-T и в некоторых случаях развитию аритмии желудочковой тахисистолической типа "пируэт" (torsade de pointes). Одновременное применение пимозида и флуконазола противопоказано. Хинидин. Несмотря на то. что не проводилось соответствующих исследований in vitro или in vivo, одновременное применение флукоиазола и хинидина может также приводить к угнетению метаболизма хинидина. Применение хинидина связано с удлинением интервала Q-T и в некоторых случаях с развитием аритмии желудочковой тахисистоли- ческой типа "пируэт" (torsade dc pointes). Одновременное применение хинидина и флуконазола противопоказано. Эритромицин. Одновременное применение флуконазола и эритромицина потенциально приводит к повышенному риску развития кардиотоксичности (удлинение интервала Q-T, torsade de pointes) и, вследствие этого, внезапной сердечной смерти. Одновременное применение флуконазола и эритромицина противопоказано. Следует соблюдать осторожность и, возможно, корректировать дозы при одновременном применении следующих препаратов и флукоиазола:Гидрохлоротиазид. Одновременное многократное применение флукоиазола и гидрохлортиазида может привести к возрастанию концентрации флуконазола в плазме крови на 40 %. Эффект такой степени выраженности не требует изменения режима дозирования флуконазола у больных, получающих одновременно диуретики, однако врачу следует это учитывать. Рифампицин. Комбинация с рифампиципом приводит к снижению AUC (площади под кривой "концентрация-время") на 25 % и укорочению периода полувыведения флуконазола из плазмы на 20 %. Поэтому больным, получающим одновременно рифампицин, дозу флуконазола целесообразно увеличить. Флуконазол является мощным ингибитором нзофермента CYP2C9 и CYP2C19 цитохрома Р450 и умеренным ингибитором изофермента CYP3A4. Помимо перечисленных далее эффектов, существует риск повышения в плазме крови концентрации и других лекарственных средств, мстаболизируемых изоферментами CYP2C9, CYP2C19 и CYP3A4 при одновременном приеме с флуконазолом.В связи с этим, следует соблюдать осторожность при одновременном применении нижеперечисленных препаратов, а при необходимости подобных комбинаций пациенты должны находиться под тщательным медицинским наблюдением. Следует учитывать, что ингибирующий эффект флуконазола сохраняется в течение 4-5 дней после отмены препарата в связи с длительным периодом полувыведения. Алфентанил. Отмечается уменьшение кли- репса и объема распределения, увеличение периода полувыведения алфентанила. Возможно, это связано с ингибированием изофермента CYP3A4 флуконазолом. Может потребоваться коррекция дозы алфентанила. Амитриптилин, нортриптилин. Увеличение эффекта. Концентрацию 5-нортриптилина и/или S-амитриптилина можно измерить в начале комбинированной терапии с флуконазолом и через неделю после начала лечения. При необходимости следует корректировать дозу амитриптили- на/нортринтилина. Амфотспицин В. В исследованиях па мышах (в том числе, с иммуносупрессисй) были отмечены следующие результаты: небольшой аддитивный противогрибковый эффект при системной инфекции, вызванной С. albicans, отсутствие взаимодействия при внутричерепной инфекции, вызванной Cryptococcus neofonmms и антагонизм при системной инфекции, вызванной Л. fumigants. Клиническое значение данных результатов не ясно. При применении флуконазола и других противогрибковых средств (производных азола) с варфарином увеличивается про- тромбиновос время (в среднем на 12 %). Возможно развитие кровотечений (гематомы, кровотечения из носа и желудочно- кишечного тракта, гематурия, мелена). У пациентов, получающих кумариновые антикоагулянты, необходимо постоянно контролировать протромбиновое время в период терапии и в течение 8 дней после одновремепного- примепения. Также следует оценить целесообразность коррекции дозы варфарина. Азитромицин. При одновременном применении внутрь флуконазола в однократной дозе 800мг с азитромицином в однократной дозе 1200 мг выраженного фармакокинетического взаимодействия между обоими препаратами не установлено. Бензодиазепины. (короткого действия). После приема внутрь мидазолама, флуконазол существенно увеличивает концентрацию мидазолама и психомоторные эффекты, причем это влияние более выражено после приема флуконазола внутрь, чем при его применении внутривенно. При необходимости сопутствующей терапии бензодиазепинами пациентов, принимающих флуконазол, следует наблюдать с целью оценки целесообразности соответствующего снижения дозы бензодиазепина. При одновременном приеме однократной дозы триазолама, флуконазол увеличивает AUC триазолама приблизительно на 50 %, С max - на 25-50 % и период полувыведения на 25-50 % благодаря угнетению метаболизма триазолама. Может понадобиться коррекция дозы триазолама. Капбамазепин. Флуконазол угнетает метаболизм карбамазепина и повышает его сывороточную концентрацию па 30 %. Необходимо учитывать риск развития токсичности карбамазепина. Следует оценить необходимость коррекции дозы карбамазепина в зависимости от концентрации/эффекта. Блокаторы кальциевых каналов. Некоторые антагонисты кальциыевых каналов (нифедипин, исрадипин, амлодипин, верапамил и фелодипин) фелодипин) метаболизируются изоферментом CYP3A4. Флуконазол увеличивает системную экспозицию антагонистов кальциевых каналов. Рекомендован контроль побочных эффектов. Циклоспорин. Рекомендуется осуществлять контроль за концентрацией циклоспорина в крови у пациентов, получающих флуконазол, так как у больных с пересаженной ночкой прием флуконазола в дозе 200 мг/сут приводит к медленному увеличению концентрации циклоспорина в плазме. Однако при многократном приеме флуконазола в дозе 100 мг/сут изменения концентрации циклоспорина у реципиентов костного мозга не наблюдалось. Циклофосфамид. При одновременном применении циклофосфамида и флуконазола отмечается увеличение сывороточных концентраций билирубина и креатинина. Сочетание препаратов возможно е учетом риска данных нарушений. Фентанил. Имеется сообщение об одном летальном исходе, возможно связанном с одновременным приемом фентанила и флуконазола. Предполагается, что нарушения связаны с интоксикацией фентанилом. Было показано, что флуконазол значительно удлиняет время выведения фентанила. Следует учитывать, что повышение концентрации фентанила может привести к угнетению дыхательной функции. Галофантрин. Флуконазол может увеличивать концентрацию галофаитина в плазме крови в связи с ингибированием изофермента CYP3A4. При одновременном применении с флуконазолом, как и с другими противогрибковыми препаратами азолового ряда возможно развитие аритмии желудочковой тахисистолической типа "пируэт", поэтому совместное применение их не рекомендуется. Ингибиторы ГМК-КоА-редуктазы. При одновновременном применении флуконазола с ингибиторами ГМК-КоА-редуктазы, метаболизируемыми изоферментом CYP3A4 (такими как аторвастатин и симвастатин) или изоферментом CYP2D6 (флувастагин), риск развития миопатии и рабдомиолиза увеличивается. В случае необходимости одновременной терапии указанными препаратами, следует наблюдать пациентов с целью выявления симптомов миопатии и рабдомиолиза. Необходимо контролировать концентрацию креатининкиназы. В случае значительного увеличения концентрации креатининкиназы или если диагностируется или имеется подозрение на развитие миопатии или рабдомиолиза, терапию ингибиторами ГМК-КоА-редуктазы следует прекратить. Лозартан. Флукопазол угнетает метаболизм лозартана до его активного метаболита (Е-31 74), который отвечает за большую часть эффектов, связанных с антагонизмом ангиотензин-II рецепторов. Необходим регулярный контроль артериального давления. Метадон. Флукопазол может увеличивать плазменную концентрацию метадона. Может понадобиться коррекция дозы метадона/Нестероидные противовоспалительные препараты (НПВП). Cmax и AUC флурбипрофена увеличиваются на 23% и 81 % соот ветственно. Аналогично С max и AUC фармакологически активного изомера [S-(+)- ибупрофен] повышались на 15 % и 82 % соответственно при одновременном применении флуконазола с рацемическим ибупрофеном (400мг). При одновременном применении флуконазола в дозе 200 мг/сут и целекоксиба в дозе 200 мг Сmах и AUC целекоксиба увеличиваются на 68 % и 134 % соответственно. В данной комбинации возможно снижение дозы целекоксиба вдвое. Несмотря на отсутствие целенаправленных исследований флуконазол может увеличивать системную экспозицию других ИПВП, метаболизирусмых изоферментом CYP2C9 (напроксен, лорноксикам, мелоксикам. диклофенак). Может понадобиться коррекция дозы ИПВП. При одновременном применении ИПВП и флуконазола пациенты должны находиться под тщательным медицинским наблюдением с целью выявления и контроля нежелательных явлений и проявлений токсичности, связанных с НПВП. Пероральные контрацептивы. При одновременном применении комбинированного перорального контрацептива с флуконазолом в дозе 50 мг существенного влияния на уровень гормонов не установлено. При ежедневном приеме 200 мг флуконазола AUC этинил- эстрадиола и левоноргестрела увеличиваются на 40 % и 24 % соответственно. При приеме 300 мг флуконазола один раз в неделю AUC этинилэстрадиола и норэтиндрона возрастают на 24 % и 13 % соответственно. Таким образом, многократное применение флуконазола в указанных дозах вряд ли может оказать влияние на эффективность комбинированного перорального противозачаточного средства. Фенитоин. Одновременное применение флуконазола и фенитоина может привести к возрастанию концентрации фенитоина в плазме до клинически значимой степени. Поэтому при необходимости совместного применения этих препаратов нужно мониторировать концентрации фенитоина с коррекцией его дозы с целью поддержания уровня препарата в пределах терапевтического интервала. Преднизон. Имеется сообщение о развитии острой недостаточности коры надпочечников у пациента после трансплантации печени на фоне отмены флуконазола после трехмесячного курса терапии. Предположительно, прекращение терапии флуконазолом вызвало повышение активности изофермента CYP3A4, что привело к увеличенному метаболизму преднизона. Пациенты, получающие комбинированную терапию преднизоном и флуконазолом должны находиться под тщательным медицинским наблюдением при отмене приема флуконазола с целью оценки состояния коры надпочечников. Рифабутин. Имеются сообщения о взаимодействии флуконазола и рифабутина, сопровождавшегося повышением сывороточных концентраций последнего до 80 %. При одновременном применении флуконазола и рифабутина описаны случаи увеита. Необходимо тщательно наблюдать больных, одновременно получающих рифабутин и флуконазол. Саквинавир. AUC повышается приблизительно на 50 %. Сmax - на 55 %. Клиренс саквинавира уменьшается приблизительно па 50 % в связи с нгибированием печеночного метаболизма изофермента CYP3A4 и Р-гликопротсина. Может понадобиться коррекция дозы саквинавира. Сиролимус. Повышение концентрации сиролимуса в плазме крови предположительно в связи с ингибированием метаболизма сиролимуса через угнетение изофермента CYP3A4 и Р-гликопротеина. Данная комбинация может применяться с соответствующей коррекцией дозы сиролимуса в зависимости от эффекта/концентрации. Пероральные гипогликемические средства. Флуконазол увеличивает период полувыведения из плазмы пероральных гипогликемических средств - производных сульфонилмочевины (хлорпропамид, глибенкламид, глипизид, толбутамид). Совместное применение флуконазола и пероральных гипогликемических средств допускается, однако врач должен иметь в виду возможность развития гипогликемии. Необходим регулярный контроль глюкозы крови и, при необходимости, коррекция дозы препаратов сульфонилмочевины. Такролимус. Применение Флуконазола и такролимуса (внутрь) приводит к повышению сывороточных концентраций последнего в 5 раз за счет ингибирования метаболизма такролимуса, происходящего в кишечнике посредством изофермента CYP3A4. Значительных изменений фармакокинетики препаратов не отмечено при применении такролимуса внутривенно. Описаны случаи исфро- токсичиости. Больных, одновременно принимающих такролимус внутрь и флуконазол, следует тщательно наблюдать. Дозу такролимуса следует корректировать в зависимости от степени повышения его концентрации в крови. Теофиллин. При применении флуконазола в дозе 200 мг в течение 14 дней одновременно (или в комбинации) с теофиллином средняя скорость плазменного клиерснса теофиллина снижается на 18 %. При назначении флуконазола больным, принимающим тсофиллин в высоких дозах, или больным с повышенным риском развития токсического действия теофиллина, следует наблюдать за появлением симптомов передозировки теофиллина и, при необходимости, скорректировать терапию соответсвтующим образом. Алкалоид барвинка. Несмотря па отсутствие целенаправленных исследований, предполагается, что флуконазол может увеличивать концентрацию алкалоидов барвинка (например, винкристина и винбластина) в плазме крови и, таким образом, приводить к исйротоксичности, что, возможно, может быть связано с угнетением изофермента CYP3A4. Витамин А. Имеется сообщение об одном случае развития нежелательных реакций со стороны центральной нервной системы (ЦНС) в виде псевдоопухоли мозга при одновременном применении полностью трансретиноевой кислоты п флуконазола, которые исчезли после отмены флуконазола. Применение данной комбинации возможно, но следует помнить о возможности возникновения нежелательных реакций со стороны ЦНС. Зидовудин. У больных, получающих комбинацию флуконазола и зидовудина, наблюдается повышение Сmах и AUC зидовудина на 84 % и 74 % соответственно, которое вызвано снижением метаболизма последнего до его главного метаболита. До и после терапии с применением флуконазола в дозе 200 мг/сут в течение 15 дней больным СПИДом и ARC (комплекс, связанный со СПИДом) установлено значительное увеличение AUC зидовудина (20 %). Больных, получающих такую комбинацию, следует наблюдать с целью выявления побочных эффектов зидовудина. Вориконазол (ингибитор изофермента CYP2C9, CYP2C19 и CYP3A4). Одновременное применение вориконазола (по 400 мг 2 раза в сутки в первый день, затем по 200 мг два раза в сутки в течение 2,5 дней) и флуконазола (400 мг в первый день, затем по 200 мг в сутки в течение 4 дней), приводит к увеличению концентрации и AUC вориконазола на 57% и 79 % соответственно. Было показано, что данный эффект сохраняется при уменьшении дозы и/или кратности приема любого из препарато . Одновременное применение вориконазола и флуконазола не рекомендуется. Тофацитиниб: экспозиция тофацитиниба увеличивается при его совместном применении с препаратами, которые являются одновременно умеренными ингибиторами изо- ферменга CYP3A4 и мощными ингибиторами изофермента CYP2C19 (например, флуконазол). Возможно, может понадобиться коррекция дозы тофацитиниба. Исследования взаимодействия пероральных форм флуконазола при его одновременном приеме с пищей, циметидином, антацидами, а также после тотального облучения тела для подготовки к пересадке костного мозга показали, что эти факторы не оказывают клинически значимого влияния на всасывание флуконазола. Перечисленные взаимодействия установлены при многократном применении флукопазола: взаимодействия с лекарственными средствами в результате однократного приема флуконазола не известны. Врачам следует учитывать, что взаимодействие с другими лекарственными средствами специально не изучалось, но оно возможно. Фармакологическое действие и фармакокинетика Флуконазол, представитель класса триазольных противогрибковых средств, является селективным ингибитором синтеза стеролов в клетке грибов. Препарат эффективен при оппортунистических микозах, в т.ч. вызванных Candida spp, Cryptococcus neoformans, Microsporum spp, Trichophyton spp. Показана также активность флуконазола на моделях эндемичных микозов, включая инфекции, вызванные Blastomyces dermatitidis, Coccidiodes immitis и Histoplasma capsulatum. Фармакокинетика: После приема внутрь флуконазол хорошо всасывается, его биодоступность - 90%. Максимальная концентрация после приема внутрь, натощак 150 мг составляет 90% от содержания в. плазме при внутривенном введении в дозе 2,5 - 3,5 мг/л. Одновременный прием пищи не влияет на абсорбцию препарата, принятого внутрь. Концентрация в плазме достигает пика через 0.5-1.5 ч после приема, период полувыведения флуконазола составляет около 30 ч. Концентрации в плазме находятся в прямо пропорциональной зависимости от дозы. 90 % уровень равновесной концентрации достигается к 4-5 дню лечения препаратом (при приеме 1 раз/сут). Введение ударной дозы (в первый день), в 2 раза превышающей обычную суточную дозу, позволяет достичь уровень, соответствующий 90% равновесной концентрации, ко второму дню. Очевидный объем распределения приближается к общему содержанию воды в организме. Связывание с белками плазмы -11-12%. Флуконазол хорошо проникает во все биологические жидкости организма. Концентрации препарата в слюне и мокроте аналогичны его уровням в плазме. У больных грибковым менингитом содержание флуконазола в спинномозговой жидкости достигает 80% от уровня его в плазме.В роговом слое, эпидермисе, дерме и потовой жидкости достигаются высокие концентрации, которые превышают сывороточные. Флуконазол выводится в основном почками: примерно 80% введенной дозы выводится в неизмененном виде. Клиренс флуконазола пропорционален клиренсу креатинина. Метаболитов флуконазола в периферической крови не обнаружено. Особые указания В редких случаях применение флуконазола сопровождалось токсическими изменениями печени, в т.ч. с летальным исходом, главным образом у больных с серьезными сопутствующими заболеваниями. В случае гепатотоксических эффектов, связанных с флуконазолом, не отмечено явной зависимости их от общей суточной дозы, длительности терапии, пола, и возраста больного. Гепатотоксическое действие флуконазола обычно было обратимым: признаки его исчезали после прекращения терапии. При появлении клинических признаков поражения печени, которые могут быть связаны с флуконазолом, препарат следует отменить. Больные СПИД более склонны к развитию тяжелых кожных реакций при применении многих препаратов. В тех случаях, когда у больных с поверхностной грибковой инфекцией развивается сыпь и она расценивается как определенно связанная с флуконазолом, препарат следует отменить. При появлении сыпи у больных с инвазивными/системными грибковыми инфекциями, их следует тщательно наблюдать и отменить флуконазол при появлении буллезных изменений или многоформной эритемы. Необходимо соблюдать осторожность при одновременном приеме флуконазола с цизапридом, рифабутином или другими препаратами, метаболизирующимися системой цитохрома Р 450. Лечение необходимо продолжать до появления клиникогематологической ремиссии, так как преждевременное его превращение приводит к рецидивам. Влияние на способность управлять транспортными средствами: В связи с возможностью возникновения головокружения и других побочных эффектов. связанных с приемом препарата, в период лечения пациентам рекомендуется воздержаться от управления автотранспортом и занятиями другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания, быстроты психомоторных и двигательных реакций. Условия хранения и отпуска из аптек Условия хранения:При температуре от 15 °С до 25 °С.В недоступном для детей месте. Отпуск из аптек: Без рецепта Регистрационные данные Торговое название Флюкостат® Международное непатентованное название:Флуконазол. Форма выпуска:капсулы. Состав:активное вещество: флуконазол 50 мг или 150 мг:вспомогательные вещества: лактоза (сахар молочный) 49.40 мг или 147,40 мг, крахмал кукурузный 16,40 мг или 49.00 мг, кремния диоксид коллоидный (аэросил) 0,12 мг или 0.36 мг, магния стеарат 0.96 мг или 2,88 мг, натрия лаурилсульфат 0.12 мг или 0,36 мг: капсулы твердые желатиновые:(для дозировки 50 мг) корпус, титана диоксид (Е 171) - 3,0000 %. железа оксид красный (Е 172) - 0.0857%, желатин - до 100%: крышечка: титана диоксид (Е 171) - 2.0000%, железа оксид красный (Е 172) - 0.7286 %. желатин - до 100 %:(для дозировки 150 мг) корпус и крышечка: титана диоксид (Е 171)- 2.0000 %, желатин - до 100 %. АТХ: Регистрация: Лекарственное средство Р N001361/01 Фармгруппа: Противогрибковое средство. Дата регистрации: 31.03.2008. Окончание регстрации: . Описание:дозировка 50 мг: непрозрачные капсулы № 2, корпус светло-розового цвета, крышечка розовато-коричневого цвета: дозировка 150 мг: непрозрачные капсулы № 0, корпус и крышечка белого цвета Упаковка:Капсулы 50 мг и 150 мг. 7 капсул по 50 мг или 1, 2, 3, 6 капсул по 150 мг в контурной ячейковой упаковке. 1 контурная ячейковая упаковка по 7 капсул (для дозировки 50 мг) или 1 контурная ячейковая упаковка по 1, 2, 3 капсулы или 4 контурные ячейковые упаковки по 6 капсул (для дозировки 150 мг) вместе с инструкцией по применению в пачке из картона. Срок годности:3 года. Не использовать позже срока, указанного на упаковке. Владелец рег.удостоверения:ФАРМСТАНДАРТ-ЛЕКСРЕДСТВА, ОАО Производитель:ФАРМСТАНДАРТ-ЛЕКСРЕДСТВА, ОАО. Представительство
355 Руб.Топамакс капс. 25мг №60
Показания Эпилепсия В качестве средства монотерапии: у взрослых и детей старше 2-х лет с эпилепсией (в том числе у пациентов с впервые диагностированной эпилепсией). В составе комплексной терапии: у взрослых и детей старше 2-х лет с парциальными или генерализованными тонико-клоническими припадками, а также для лечения припадков на фоне синдрома Леннокса-Гасто. Мигрень Профилактика приступов мигрени у взрослых. Применение препарата Топамакс® для лечения острых приступов мигрени не изучено. Противопоказания Противопоказания Повышенная чувствительность к любому из компонентов данного препарата, детский возраст до 2-х лет. Применение топирамата для профилактики приступов мигрени противопоказано в период беременности, а также у женщин с сохраненным детородным потенциалом, не использующих надежные методы контрацепции. С осторожностью: При почечной и печеночной недостаточности, нефроуролитиазе (в т.ч. в прошлом и в семейном анамнезе), гиперкальциурии. Беременность Топирамат проявлял тератогенные свойства у мышей, крыс и кроликов. У крыс топирамат проникал через плацентарный барьер. Специальных контролируемых исследовании, в которых Топамакс® применялся бы для лечения беременных женщин, не проводилось. Топирамат может причинить вред плоду при применении у беременных женщин. Данные учета беременностей свидетельствуют, что у младенцев, подвергавшихся воздействию топирамата внутриутробно в течение первого триместра беременности, имеется повышенный риск развития врожденных пороков развития (например, черепно-лицевые дефекты, такие как расщелина губы или неба, гипоспадия и аномалии развития различных систем организма). Указанные пороки развития были зафиксированы как при монотерапии топираматом, так и при его применении в рамках политерапии. Данные одного из реестров беременностей показали, что при монотерапии топираматом частота возникновения значительных врожденных пороков развития увеличивается примерно в 3 раза по сравнению с группой сравнения, не принимавшей противоэпилептические препараты. Кроме того, показано, что риск развития тератогенных эффектов, ассоциированных с приемом противоэпилептических препаратов, выше в случае применения комбинированной терапии, чем в случае применения монотерапии. По сравнению с группой пациентов, не принимающих противоэпилептические препараты, данные учета беременностей при монотерапии препаратом Топамакс® свидетельствуют об увеличении вероятности рождения детей с низкой массой тела (менее 2500 г). Один из регистров беременностей показал увеличение относительного числа младенцев, недоразвитых для своего гестационного возраста (НГВ: определяется как масса тела при рождении ниже 10-го перцентиля с корректировкой по гестационному возрасту и стратификацией по полу), среди младенцев, подвергавшихся воздействию топирамата внутриутробно. Долгосрочные последствия НГВ не определены. Причина уменьшения массы тела при рождении и НГВ не установлена. Во время терапии топираматом женщины с сохраненным детородным потенциалом должны использовать надежные методы контрацепции. Применение препарата Топамакс® при беременности у женщин с неконтролируемой эпилепсией оправдано лишь в том случае, когда потенциальная польза от применения препарата для матери превышает возможный риск для плода. Применение топирамата для профилактики приступов мигрени противопоказано в период беременности, а также у женщин с сохраненным детородным потенциалом, не использующих надежные методы контрацепции. При лечении и консультации женщин, обладающих детородным потенциалом, лечащий врач должен взвесить соотношение пользы и риска лечения и рассмотреть альтернативные возможности лечения. Если Топамакс® применяется во время беременности, или если пациентка забеременела в период приема этого препарата, ее следует предупредить о потенциальном риске для плода. Ограниченное число наблюдений за пациентами позволяет предположить, что топирамат экскретируется с грудным молоком у женщин, поэтому врач должен принять решение об отказе от грудного вскармливания или о прекращении приема препарата. При исследовании у животных не было обнаружено влияния топирамата на фертильность. Эффект топирамата в отношении фертильности у людей не установлен. Применение и дозы Внутрь, вне зависимости от приема пищи. Для достижения оптимального контроля эпилептических приступов у детей и взрослых пациентов рекомендуется начинать лечение с приема низких доз препарата с последующим постепенным титрованием до эффективной дозы. Капсулы предназначены для пациентов, испытывающих трудности с проглатыванием таблеток (например, дети и пожилые пациенты). Капсулы Топамакс® следует осторожно открыть, смешать содержимое капсул с небольшим количеством (около 1 чайной ложки) какой-либо мягкой пищи. Эту смесь следует немедленно проглотить, не разжевывая. Не следует хранить лекарственный препарат, смешанный с пищей, до следующего приема. Капсулы Топамакс® можно проглатывать целиком. Парциальные или генерализованные тонико-клонические припадки, а также припадки на фоне синдрома Леннокса-Гасто Применение в комбинации с другими противосудорожными препаратами у взрослых пациентов Минимальная эффективная доза составляет 200 мг в день. Обычно суммарная суточная доза составляет от 200 мг до 400 мг и принимается в два приема. Некоторым больным может понадобиться увеличение суточной дозы до максимальной - 1600 мг. Рекомендуется начать лечение с низкой дозы с последующим постепенным подбором эффективной дозы. Подбор дозы начинают с 25-50 мг, принимая их на ночь в течение 1 недели. В дальнейшем с недельными или двухнедельными интервалами дозу можно увеличивать на 25-50 мг и принимать ее в два приема. При подборе дозы необходимо руководствоваться клиническим эффектом. У некоторых больных эффект может быть достигнут при приеме препарата 1 раз в сутки. Для достижения оптимального эффекта лечения препаратом Топамакс® не обязательно контролировать его концентрацию в плазме. Данные рекомендации по дозе применимы ко всем взрослым пациентам, включая пожилых людей, при отсутствии у них заболевания почек (см. раздел “Особые указания”). Комбинированная противосудорожная терапия у детей старше 2 лет Рекомендуемая суммарная суточная доза препарата Топамакс® в качестве средства дополнительной терапии составляет от 5 до 9 мг/кг и принимается в два приема. Подбор дозы необходимо начать с 25 мг (или менее, основываясь на начальной дозе от 1 до 3 мг/кг в день), принимая их на ночь в течение 1 недели. В дальнейшем с недельными или двухнедельными интервалами дозу можно увеличивать на 1-3 мг/кг и принимать ее в два приема. При подборе дозы необходимо руководствоваться клиническим эффектом. Суточная доза до 30 мг/кг обычно хорошо переносится. Эпилепсия (в том числе впервые диагностированная) Монотерапия: общие положения При отмене сопутствующих противосудорожных препаратов с целью монотерапии топираматом необходимо учитывать возможное влияние этого шага на частоту припадков. В тех случаях, когда нет необходимости резко отменять сопутствующие противосудорожные препараты по соображениям безопасности, рекомендуется снижать их дозы постепенно, уменьшая дозу сопутствующих противоэпилептических препаратов на одну треть каждые 2 недели. При отмене препаратов, являющихся индукторами микросомальных ферментов печени, будут возрастать концентрации топирамата в крови. В таких ситуациях, при наличии клинических показаний дозу препарата Топамакс® можно снизить. Монотерапия: взрослые В начале лечения пациент должен принимать по 25 мг препарата Топамакс® перед сном в течение 1 недели. Затем дозу повышают с интервалом в 1-2 недели на 25 или 50 мг (суточную дозу делят на два приема). Если пациент не переносит такой режим повышения дозы, то можно увеличить интервалы между повышениями дозы, либо повышать дозу более плавно. При подборе дозы необходимо руководствоваться клиническим эффектом. Начальная доза при монотерапии топираматом у взрослых составляет 100 мг в сутки, а максимальная суточная доза не должна превышать 500 мг. Некоторые пациенты с рефрактерными формами эпилепсии переносят монотерапию топираматом в дозах до 1000 мг в сутки. Данные рекомендации по дозированию относятся ко всем взрослым, включая пожилых пациентов без заболеваний почек. Монотерапия: дети Детям в возрасте старше 2 лет в первую неделю лечения следует давать топирамат в дозе 0,5-1 мг/кг массы тела перед сном. Затем дозу повышают с интервалом в 1-2 недели на 0,5-1 мг/кг в сутки (суточную дозу делят на два приема). Если ребенок не переносит такой режим повышения дозы, то можно повышать дозу более плавно или увеличивать интервалы между повышениями дозы. Величина дозы и скорости ее повышения должны определяться клиническим результатом. Рекомендуемый диапазон доз при монотерапии топираматом у детей в возрасте старше 2 лет составляет 100 - 400 мг/сутки. Детям с недавно диагностированными парциальными припадками можно назначать до 500 мг в сутки. Мигрень Рекомендуемая общая суточная доза топирамата для профилактики приступов мигрени составляет 100 мг, принимаемая в 2 приема. В начале лечения пациент должен принимать по 25 мг препарата Топамакс® перед сном в течение 1 недели. Затем дозу увеличивают с интервалом в 1 неделю на 25 мг в сутки. Если пациент не переносит такого режима повышения дозы, то можно увеличить интервалы между увеличениями дозы, либо повышать дозу более плавно. При подборе дозы необходимо руководствоваться клиническим эффектом. У некоторых пациентов положительный результат достигается при суточной дозе топирамата 50 мг. В клинических исследованиях пациенты получали различные суточные дозы топирамата, но не более 200 мг в сутки. Особые группы пациентов 1. Почечная недостаточность Пациентам с умеренной или тяжелой почечной недостаточностью может понадобиться снижение дозы. Рекомендуется применение половины рекомендуемой начальной и поддерживающей дозы. 2. Гемодиализ Поскольку топирамат удаляется из плазмы при гемодиализе, в дни проведения гемодиализа следует вводить дополнительную дозу препарата Топамакс®, равную примерно половине суточной дозы. Дополнительная доза должна быть разделена на две дозы, принимаемые в начале и после завершения процедуры гемодиализа. Дополнительная доза может варьировать в зависимости от характеристик оборудования, используемого при проведении гемодиализа. 3. Печеночная недостаточность Пациентам с печеночной недостаточностью топирамат следует применять с осторожностью. Побочные эффекты и передозировка Побочные эффекты: Нежелательные реакции приведены с распределением по частотам и системам органов. Частоту нежелательных реакций классифицировали следующим образом: очень часто ( 1/10), часто ( 1/100, <:1/10), нечасто ( 1/1000 и <:1/100), редко ( 1/10000 и <:1/1000), очень редко (<:1/10000, включая отдельные случаи) и частота неизвестна (частоту невозможно оценить по имеющимся данным). Наиболее частыми нежелательными реакциями (частота которых была более 5% и превышала таковую в группе плацебо по крайней мере для одного из показаний в ходе контролируемых клинических исследований топирамата) являются: анорексия, понижение аппетита, замедленное мышление, депрессия, нарушения свободной речи, бессонница, нарушения координации движений, нарушение концентрации внимания, головокружение, дизартрия, дисгевзия, гипестезия, заторможенность, нарушения памяти, нистагм, парестезия, сонливость, тремор, диплопия, нечеткость зрения, диарея, тошнота, усталость, раздражительность и понижение массы тела. Инфекции и инвазии: очень часто: назофарингит. Нарушения со стороны крови и лимфатической системы: часто: анемия: нечасто: лейкопения, лимфаденопатия, тромбоцитопения, эозинофилия: редко: нейтропения. Нарушения со стороны иммунной системы: часто: гиперчувствительность: частота неизвестна: аллергический отек, отек конъюнктивы. Нарушения со стороны метаболизма и питания: часто: анорексия, понижение аппетита: нечасто: метаболический ацидоз, гипокалиемия, повышение аппетита, полидипсия: редко: гиперхлоремический ацидоз: гипераммониемия, гипераммониемическая энцефалопатия. Психические нарушения: очень часто: депрессия: часто: замедленное мышление, бессонница, нарушения свободной речи, тревога, спутанность сознания, дезориентация, агрессивные реакции, нарушения настроения, возбуждение, эмоциональная лабильность, депрессивное настроение, гнев, нарушение поведения: нечасто: суицидальные мысли, попытки суицида, галлюцинации, психотические расстройства, слуховые галлюцинации, зрительные галлюцинации, апатия, затрудненная речь, нарушения сна, аффективная лабильность, снижение либидо, возбужденное состояние, плач, дисфемия, эйфорическое настроение, паранойя, персеверация мышления, панические атаки, плаксивость, нарушение навыков чтения, нарушение засыпания, уплощение эмоций, патологическое мышление, потеря либидо, вялость, интрасомническое расстройство, рассеянность, ранние пробуждения по утрам, панические реакции, приподнятое настроение: редко: мания, паническое расстройство, чувство безысходности, гипомания. Нарушения со стороны центральной нервной системы: очень часто: парестезии, сонливость, головокружение: часто: нарушение концентрации внимания, нарушение памяти, амнезия, когнитивные расстройства, нарушение мышления, психомоторные нарушения, судороги, нарушение координации движений, тремор, заторможенность, гипестезия, нистагм, дисгевзия, нарушение чувства баланса, дизартрия, интенционный тремор, седация: нечасто: угнетенное сознание, тонико- клонические припадки по типу "grand mal", нарушение поля зрения, сложные парциальные припадки, нарушение речи, психомоторная гиперактивность, обморок, сенсорные нарушения, слюнотечение, гиперсомния, афазия, повторяющаяся речь, гипокинезия, дискинезия, постуральное головокружение, низкое качество сна, ощущение жжения, потеря чувствительности, паросмия, церебральный синдром, дизестезия, гипогевзия, ступор, неуклюжесть, аура, агевзия, дисграфия, дисфазия, периферическая нейропатия, предобморочное состояние, дистония, ощущение "мурашек" по телу: редко: апраксия, нарушение циркадного ритма сна, гиперестезия, гипосмия, аносмия, эссенциальный тремор, акинезия, отсутствие реакций на раздражители. Нарушения со стороны органа зрения: часто: нечеткость зрения, диплопия, нарушение зрения: нечасто: уменьшение остроты зрения, скотома, миопия, странные ощущения в глазах, сухость глаз, светобоязнь, блефароспазм, повышенное слезотечение, фотопсия, мидриаз, пресбиопия: редко: односторонняя слепота, преходящая слепота, глаукома, нарушение аккомодации, нарушение зрительного пространственного восприятия, мерцательная скотома, отек век, ночная слепота, амблиопия: частота неизвестна: закрытоугольная глаукома, макулопатия, нарушения подвижности глаза. Нарушения со стороны органа слуха и равновесия: часто: вертиго, звон в ушах, боль в ухе: нечасто: глухота, односторонняя глухота, нейросенсорная глухота, дискомфорт в ухе, нарушение слуха. Нарушения со стороны сердечно-сосудистой системы: нечасто: брадикардия, синусная брадикардия, ощущение сердцебиения. Нарушения со стороны сосудистой системы: нечасто: гипотензия, ортостатическая гипотензия, приливы, горячие приливы: редко: феномен Рейно. Нарушения со стороны дыхательной системы, органов грудной клетки и средостения: часто: одышка, носовое кровотечение, заложенность носа, ринорея, кашель: нечасто: одышка при физической нагрузке, гиперсекреция в придаточных пазухах носа, дисфония. Нарушения со стороны желудочно-кишечного тракта: очень часто: тошнота, диарея: часто: рвота, запор, боль в эпигастральной области, диспепсия, боль в животе, сухость во рту, дискомфорт в желудке, нарушение чувствительности в ротовой полости, гастрит, дискомфорт в животе: нечасто: панкреатит, метеоризм, гастроэзофагеальный рефлюкс, боль в нижней части живота, снижение чувствительности в ротовой полости, кровоточивость десен, вздутие живота, дискомфорт в эпигастральной области, чувствительность в области живота, гиперсаливация, боль в ротовой полости, неприятный запах изо рта, глоссодиния. Нарушения со стороны гепатобилиарной системы: редко: гепатит, печеночная недостаточность. Нарушения со стороны кожи и подкожных тканей: часто: алопеция, сыпь, зуд: нечасто: ангидроз, нарушение чувствительности в области лица, крапивница, эритема, генерализованный зуд, макулярная сыпь, нарушение пигментации кожи, аллергический дерматит, припухлость лица: нечасто: синдром Стивенса-Джонсона, полиморфная эритема, изменение запаха кожи, параорбитальный отек, локализованная крапивница: частота неизвестна: токсический эпидермальный некролиз. Нарушения со стороны скелетно-мышечной системы и соединительной ткани: часто: артралгия, мышечные спазмы, миалгия, мышечные судороги, мышечная слабость, скелетно-мышечная боль в грудной клетке: нечасто: припухлость суставов, скованность мышц, боли в боку, усталость в мышцах: редко: дискомфорт в конечностях. Нарушения со стороны почек и мочевыводящих путей: часто: нефролитиаз, поллакиурия, дизурия: нечасто: обострение мочекаменной болезни (камни в почках), недержание мочи при напряжении, гематурия, недержание мочи, частые позывы к мочеиспусканию, почечная колика, боли в области почек: редко: обострение мочекаменной болезни (камни в уретре) почечноканальцевый ацидоз. Нарушения со стороны половых органов и молочной железы: нечасто: эректильная дисфункция, сексуальная дисфункция. Общие расстройства и нарушения, обусловленные способом применения: очень часто: усталость: часто: повышенная температура тела, астения, раздражительность, нарушения походки, плохое самочувствие, беспокойство: нечасто: гипертермия, жажда, гриппоподобный синдром, медлительность, похолодание конечностей, чувство опьянения, ощущение беспокойства: редко: отек лица, кальциноз. Изменение лабораторных показателей: очень часто: снижение массы тела: часто: увеличение массы тела: нечасто: кристаллурия, аномальный результат теста "тандем-походка", лейкопения, повышение активности печеночных ферментов в сыворотке крови, редко: уменьшение содержания гидрокарбонатов в крови. Нарушения социального функционирования: нечасто: нарушение способности к обучению. - нежелательная реакция зарегистрирована в пострегистрационном периоде из спонтанных сообщений. Частота рассчитана на основании данных клинических исследований. Особые группы: Дети: Ниже приведен список нежелательных реакций, которые в ходе контролируемых клинических исследований регистрировались у детей в 2 и более раз чаще, чем у взрослых: понижение аппетита, повышение аппетита, гиперхлоремический ацидоз, гипокалиемия, нарушения поведения, агрессивные реакции, апатия, нарушение засыпания, суицидальные мысли, нарушение концентрации внимания, заторможенность, нарушение циркадного ритма сна, низкое качество сна, повышенное слезотечение, синусная брадикардия, плохое самочувствие, нарушения походки. Ниже приведен список нежелательных реакций, которые в ходе контролируемых клинических исследований регистрировались только у детей: эозинофилия, психомоторная гиперактивность, вертиго, рвота, гипертермия, пирексия, нарушение способности к обучению. Передозировка: Признаки и симптомы передозировки препарата Топамакс®: судороги, сонливость, нарушения речи и зрения, диплопия, нарушения мышления, нарушения координации, летаргия, ступор, артериальная гипотензия, боль в животе, головокружение, возбуждение и депрессия. В большинстве случаев клинические последствия не были тяжелыми, но были отмечены смертельные случаи после передозировки с использованием смеси нескольких лекарственных средств, включая топирамат. Передозировка топирамата может вызвать тяжелый метаболический ацидоз (см. раздел "Особые указания"). Лечение При острой передозировке препарата Топамакс®, если незадолго перед этим больной принимал пищу, необходимо сразу же промыть желудок или вызвать рвоту. В исследованиях in vitro было показано, что активированный уголь адсорбирует топирамат. При необходимости следует провести симптоматическую терапию. Эффективным способом выведения топирамата из организма является гемодиализ. Пациентам рекомендуется адекватное повышение объема потребляемой жидкости. Взаимодействие с другими ЛС: Влияние препарата Топамакс® на концентрации других противоэпилептических препаратов (ПЭП) Одновременный приём препарата Топамакс® с другими ПЭП (фенитоин, карбамазепин, вальпроевая кислота, фенобарбитал, примидон) не оказывает влияния на значения их равновесных концентраций в плазме, за исключением отдельных больных, у которых добавление препарата Топамакс® к фенитоину может вызвать повышение концентрации фенитоина в плазме. Это может быть связано с угнетением специфической полиморфной изоформы фермента системы цитохрома Р450 (CYP2. Cmeph). Поэтому у каждого больного, который принимает фенитоин и у которого развиваются клинические признаки или симптомы токсичности, необходимо следить за концентрацией фенитоина в плазме. В исследовании фармакокинетики у больных эпилепсией добавление топирамата к ламотриджину не влияло на равновесную концентрацию последнего при дозах топирамата 100-400 мг в сутки. В процессе и после отмены ламотриджина (средняя доза 327 мг в сутки) равновесная концентрация топирамата не изменялась. Воздействие других противоэпилептических препаратов па концентрацию препарата Топамакс® Фенитоин и карбамазепин снижают концентрации препарата Топамакс® в плазме. Добавление или отмена фенитоина или карбамазепина на фоне лечения препаратом Топамакс® может потребовать изменения дозы последнего. Дозу следует подбирать, ориентируясь на достижение необходимого клинического эффекта. Добавление или отмена вальпроевой кислоты не вызывает клинически значимых изменений концентрации препарата Топамакс® в плазме и, следовательно, не требует изменения дозы препарата Топамакс®. Результаты этих взаимодействий суммированы в следующей таблице: ТАБЛИЦЪ а выражена в % от значений максимальной концентрации в плазме крови и AUC при монотерапии ↔ = Отсутствие изменений максимальной концентрации в плазме крови и AUC ( 15% от исходных данных) b При многократном приеме одного флунаризина наблюдалось увеличение AUC на 14%, что может быть связано с накоплением препарата в процессе достижения равновесного состояния. Фармакологическое действие и фармакокинетика Топирамат является противоэпилептическим препаратом, относящимся к классу сульфамат-замещенных моносахаридов. Топирамат блокирует натриевые каналы и подавляет возникновение повторных потенциалов действия на фоне длительной деполяризации мембраны нейрона. Топирамат повышает активность γ-аминомасляной кислоты (ГАМК) в отношении некоторых подтипов ГАМК-рецепторов (в том числе ГАМКА-рецепторов), а также модулирует активность самих ГАМКА-рецепторов, препятствует активации каинатом чувствительности подтипа каинат/АМПК (α-амино-3-гидрокси-5-метилизоксазол-4-пропионовая кислота)-рецепторов к глутамату, не влияет на активность N-метил-D-аспартата (NMDA) в отношении подтипа NMDA-рецепторов. Эти эффекты топирамата являются дозозависимыми при концентрации препарата в плазме от 1 мкмоль до 200 мкмоль, с минимальной активностью в пределах от 1 мкмоль до 10 мкмоль. Кроме того, топирамат угнетает активность некоторых изоферментов карбоангидразы. По выраженности этого фармакологического эффекта топирамат значительно уступает ацетазоламиду - известному ингибитору угольной ангидразы, поэтому эта активность топирамата не считается основным компонентом его противоэпилептической активности. Фармакокинетика: Топирамат всасывается быстро и эффективно. Его биодоступность составляет 81%. Прием пищи не оказывает клинически значимого действия на биодоступность топирамата. С белками плазмы связывается 13-17% топирамата. После однократного приёма в дозе до 1200 мг средний объем распределения составляет 0,55-0,8 л/кг. Величина объема распределения зависит от пола: у женщин он составляет примерно 50% от значений, наблюдаемых у мужчин, что связывают с более высоким содержанием жировой ткани в организме женщин. После приема внутрь метаболизируется около 20% от принятой дозы. Однако у больных, получающих сопутствующую терапию противоэпилептическими препаратами, которые индуцируют ферменты, отвечающие за метаболизм лекарственных средств, метаболизм топирамата повышается до 50%. Из плазмы, мочи и фекалий человека были выделены и идентифицированы шесть практически неактивных метаболитов. Основным путем выведения неизмененного топирамата (70%) и его метаболитов являются почки. После перорального введения плазменный клиренс топирамата составляет 20-30 мл/мин. Фармакокинетика топирамата носит линейный характер, плазменный клиренс остается постоянным, а площадь под кривой "концентрация-время" (AUC) в диапазоне доз от 100 до 400 мг возрастает пропорционально дозе. У больных с нормальной функцией почек для достижения устойчивой концентрации в плазме может понадобиться от 4 до 8 дней. Величина максимальной концентрации (Сmax) после многократного перорального приема 100 мг препарата дважды в день в среднем составила 6,76 мкг/мл. После многократного приема доз по 50 и 100 мг дважды в день период полувыведения топирамата из плазмы в среднем составил 21 час. У больных с нарушениями функции почек средней и тяжелой степени плазменный и почечный клиренс топирамата снижается (клиренс креатинина (КК) <: 70 мл/мин), как следствие возможно повышение равновесной концентрации топирамата в плазме крови по сравнению с пациентами, имеющими нормальную функцию почек. Кроме того, пациентам с нарушениями функции почек требуется больше времени для достижения равновесной концентрации топирамата в крови. Пациентам со средней или тяжелой почечной недостаточностью рекомендуется применение половины рекомендованной начальной и поддерживающей дозы. Топирамат эффективно выводится из плазмы путем гемодиализа. Длительный гемодиализ может привести к снижению концентрации топирамата в крови ниже количества, требующегося для поддержания противосудорожной активности. Во избежание быстрого падения концентрации топирамата в плазме во время гемодиализа может потребоваться назначение дополнительной дозы препарата Топамакс®. При коррекции дозы следует принимать во внимание: 1) продолжительность гемодиализа, 2) величина клиренса используемой системы гемодиализа, 3) эффективный почечный клиренс топирамата у пациента, находящегося на диализе. Плазменный клиренс топирамата снижается в среднем на 26% у пациентов с печеночной недостаточностью средней или тяжелой степени. Поэтому пациентам с печеночной недостаточностью следует применять топирамат с осторожностью. У пожилых пациентов без заболеваний почек плазменный клиренс топирамата не меняется. Фармакокинетика топирамата у детей до 12 лет Фармакокинетические параметры топирамата у детей так же, как у взрослых, получающих этот препарат в качестве вспомогательной терапии, носят линейный характер, при этом его клиренс не зависит от дозы, а равновесные концентрации в плазме возрастают пропорционально повышению дозы. Следует учитывать, однако, тот факт, что у детей клиренс топирамата повышен, а период его полувыведения более короткий. Следовательно, при одной и той же дозе, в расчете на 1 кг массы тела, концентрации топирамата в плазме у детей могут быть ниже, чем у взрослых. У детей, как и у взрослых, противоэпилептические препараты, индуцирующие микросомальные ферменты печени, вызывают снижение концентраций топирамата в плазме. Особые указания Противоэпилептические препараты, включая и Топамакс®, следует отменять постепенно, чтобы свести к минимуму возможность повышения частоты припадков. В клинических исследованиях дозы уменьшали на 50-100 мг с недельными интервалами для взрослых при терапии эпилепсии и на 25-50 мг у взрослых, получающих 100 мг препарата Топамакс® в сутки для профилактики мигрени. У детей в клинических исследованиях Топамакс® постепенно отменяли в течение 2-8 недель. Если по медицинским показаниям необходима быстрая отмена препарата Топамакс®, то рекомендуется осуществлять соответствующий контроль состояния пациента. Как и в случае применения других противоэпилептических препаратов, у некоторых пациентов, принимающих топирамат, наблюдается повышение частоты припадков или новые типы припадков. Данное явление может являться последствием передозировки, снижения концентрации совместно применяемых противоэпилептических препаратов, прогрессирования заболевания или парадоксального эффекта. Скорость выведения через почки зависит от функции почек и не зависит от возраста. У больных с умеренным или выраженным нарушением функции почек для достижения устойчивых концентраций в плазме может понадобиться от 10 до 15 дней, в отличие от 4-8 дней у больных с нормальной функцией почек. Как и при любом заболевании, схема подбора дозы должна ориентироваться на клинический эффект (т.е. степень контролирования припадков, отсутствие побочных эффектов) и учитывать то, что у больных с нарушением функции почек для установления стабильной концентрации в плазме для каждой дозы может понадобиться более продолжительное время. При терапии топираматом возможно возникновение олигогидроза (уменьшенное потоотделение) и ангидроза. Уменьшение потоотделения и гипертермия (повышение температуры тела) могут возникнуть у детей, подверженных воздействию высокой температуры окружающей среды. В этой связи при терапии топираматом очень важно адекватное повышение объема потребляемой жидкости, способное снизить риск развития нефролитиаза, а также побочных эффектов, которые могут возникнуть под воздействием физических нагрузок или повышенных температур. Расстройства настроения/ депрессия При лечении топираматом наблюдается повышенная частота возникновения расстройств настроения и депрессии. Суицидальные попытки При применении противоэпилептических препаратов, включая препарат Топамакс®, увеличивается риск появления суицидальных мыслей и суицидального поведения у пациентов, принимающих эти препараты по любым из показаний. В двойных слепых клинических исследованиях, частота развития явлений, связанных с суицидом (суицидальные мысли, попытки суицида, суицид), составляла 0,5% у пациентов, получавших топирамат (у 46 человек из 8652), что примерно в 3 раза выше по сравнению пациентами, получавшими плацебо (0,2%: у 8 человек из 4045). Один случай суицида был зафиксирован в двойном слепом исследовании биполярного расстройства у пациента, получавшего топирамат. Таким образом, необходимо контролировать состояние пациентов с целью выявления признаков суицидальных мыслей и назначать соответствующее лечение. Необходимо рекомендовать пациентам (и при необходимости лицам, ухаживающим за пациентами) сразу же обращаться за медицинской помощью в случае появления признаков суицидальных мыслей или суицидального поведения. Нефролитиаз У некоторых больных, в особенности, с предрасположенностью к нефролитиазу, может повыситься риск образования камней в почках и появления связанных с ним симптомов, таких как почечная колика, боль в почке, боль в боку. Чтобы уменьшить этот риск, необходимо адекватное повышение объема потребляемой жидкости. Факторами риска развития нефролитиаза являются нефролитиаз в анамнезе (в т.ч. в семейном), гиперкальциурия, сопутствующая терапия препаратами, которые способствуют развитию нефролитиаза. Нарушение функции почек Следует соблюдать осторожность при назначении препарата Топамакс® пациентам с почечной недостаточностью (клиренс креатинина <:70 мл/мин). Это связано с тем, что у таких пациентов клиренс препарата понижен. Нарушение функции печени У пациентов с нарушениями функции печени топирамат следует применять с осторожностью из-за возможного снижения клиренса этого препарата. Миопия и вторичная закрытоугольная глаукома При применении препарата Топамакс® описан синдром, включающий острую миопию с сопутствующей вторичной закрытоугольной глаукомой. Симптомы включают острое снижение остроты зрения и/или боль в глазу. При офтальмологическом обследовании может обнаруживаться миопия, уплощение передней камеры глаза, гиперемия (покраснение) глазного яблока, повышение внутриглазного давления. Может наблюдаться мидриаз. Этот синдром может сопровождаться секрецией жидкости, приводящей к смещению хрусталика и радужной оболочки вперед с развитием вторичной закрытоугольной глаукомы. Симптомы обычно появляются через 1 месяц после начала применения препарата Топамакс®. В отличие от первичной открытоугольной глаукомы, которая редко наблюдается у больных до 40 лет, вторичная закрытоугольная глаукома наблюдается при применении топирамата как у взрослых, так и у детей. При возникновении синдрома, включающего миопию, связанную с закрытоугольной глаукомой, лечение включает прекращение приема препарата Топамакс®, как только лечащий врач сочтет это возможным, и соответствующие меры, направленные на понижение внутриглазного давления. Обычно эти меры приводят к нормализации внутриглазного давления. Повышенное внутриглазное давление любой этиологии при отсутствии адекватного лечения может привести к серьезным осложнениям, вплоть до потери зрения. При назначении топирамата пациентам с заболеваниями глаз в анамнезе необходимо оценить отношение ожидаемой пользы к возможному риску применения. Дефекты поля зрения Дефекты поля зрения наблюдались у пациентов, принимающих топирамат, независимо от наличия у них повышенного внутриглазного давления. В ходе клинических исследований большинство таких случаев имели обратимый характер, и дефекты поля зрения исчезали после отмены терапии топираматом. При возникновении проблем со зрением во время приема топирамата, следует рассмотреть возможность прекращения терапии. Метаболический ацидоз При применении топирамата может возникать гиперхлоремический, не связанный с дефицитом анионов, метаболический ацидоз (например, снижение концентрации гидрокарбонатов в плазме ниже нормального уровня при отсутствии респираторного алкалоза). Подобное снижение концентрации гидрокарбонатов сыворотки крови является следствием ингибирующего эффекта топирамата на почечную карбоангидразу. В большинстве случаев, снижение концентрации гидрокарбонатов происходит в начале приема препарата, хотя данный эффект может проявиться в любом периоде лечения топираматом. Степень снижения концентрации обычно слабая или умеренная (среднее значение составляет 4 ммоль/л при использовании у взрослых пациентов в дозе выше 100 мг в день и около 6 мг в день на кг массы тела при использовании в педиатрической практике). В редких случаях у пациентов отмечалось снижение концентрации гидрокарбонатов ниже уровня 10 ммоль/л. Некоторые заболевания или способы лечения, предрасполагающие к развитию ацидоза (например, заболевания почек, тяжелые респираторные заболевания, эпилептический статус, диарея, хирургические вмешательства, кетогенная диета, прием некоторых лекарственных препаратов) могут быть дополнительными факторами, усиливающими гидрокарбонат-снижающий эффект топирамата. У детей хронический метаболический ацидоз может приводить к замедлению роста. Эффект топирамата на рост и возможные осложнения, связанные с костной системой, не изучались систематически у детей и у взрослых. В связи с вышеизложенным при лечении топираматом рекомендуется проводить необходимые исследования, включая определение концентрации гидрокарбонатов в сыворотке. В случае появления симптомов метаболического ацидоза (например, глубокое куссмаулевское дыхание, диспноэ, анорексия, тошнота, рвота, повышенная утомляемость, тахикардия или аритмия) рекомендуется проведение определения концентрации гидрокарбонатов в сыворотке. При возникновении метаболического ацидоза и его персистировании, рекомендуется снизить дозу или прекратить прием топирамата. Нарушение когнитивных функций Нарушение когнитивных функций при эпилепсии имеет многофакторную природу, и может быть вызвано первопричиной заболевания, непосредственно эпилепсией или противоэпилептической терапией. У взрослых пациентов, принимающих топирамат, отмечались случаи нарушения когнитивных функций, требовавшие снижения дозы или прекращения терапии. Данные по влиянию топирамата на когнитивные функции у детей недостаточны, и его эффекты требуют дальнейшего изучения. Гипераммониемия и энцефалопатия При применении топирамата отмечалось развитие гипераммониемии с энцефалопатией или без неё (см. раздел "Побочное действие"). Риск развития гипераммониемии при применении топирамата является дозозависимым. Гипераммониемия более часто отмечается при одновременном применении топирамата и вальпроевой кислоты (см. раздел "Другие лекарственные взаимодействия"). Клиническими симптомами гипераммониемической энцефалопатии часто являются резкое нарушение сознания и/или когнитивной функции и летаргия. В большинстве случаев гипераммониемическая энцефалопатия регрессирует при отмене терапии. У пациентов с развившейся летаргией или изменениями ментального статуса неясного генеза, получающих топирамат в виде монотерапии или в составе комбинированной терапии, рекомендовано принимать во внимание возможность гипераммониемической энцефалопатии и определить уровень аммиака в крови. Усиленное питание Если пациент теряет массу тела при лечении препаратом Топамакс®, то необходимо рассмотреть вопрос о целесообразности усиленного питания. Влияние на способность управлять транспортными средствами: Топамакс® действует на центральную нервную систему и может вызывать сонливость, головокружение и другие симптомы. Он также может вызывать нарушение зрения. Эти неблагоприятные явления могут представлять опасность для больных, управляющих автомобилем и движущимися механизмами, особенно в период, пока не будет установлена реакция больного на препарат. Условия хранения и отпуска из аптек Условия хранения:Хранить в сухом месте, при температуре не выше 25 °С. Хранить в недоступном для детей месте. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Топамакс® Международное непатентованное название:Топирамат. Форма выпуска:Капсулы. Состав:Для дозировки 15 мг: Активное вещество: топирамат 15 мг. Вспомогательные вещества: сахарная крупка [сахароза, патока крахмальная] 45,00 мг, повидон 10,4199 мг, целлюлозы ацетат 5,423 мг: Состав капсулы: желатин 50,8-52,7 мг, вода 9,3-11,2 мг, сорбитана лаурат 0,0252 мг, натрия лаурилсульфат 0,0252 мг, титана диоксид (Е171) 0,63 мг, чернила Opacode Black S-1-17822/23 черные (состав чернил: раствор глазури шеллака в этаноле, железа оксид черный, н-бутиловый спирт, изопропиловый спирт, пропиленгликоль, аммония гидроксид) 5-10 мкг. Для дозировки 25 мг: Активное вещество: топирамат 25 мг. Вспомогательные вещества: сахарная крупка [сахароза, патока крахмальная] 75,00 мг, повидон 17,3665 мг, целлюлозы ацетат 9,038 мг. Состав капсулы: желатин 64,7-67,0 мг, вода 10,0-12,3 мг, сорбитана лаурат 0,0312 мг, натрия лаурил сульфат 0,0312 мг, титана диоксид (Е171) 0,78 мг, чернила Opacode Black S-1-17822/23 черные (состав чернил: раствор глазури шеллака в этаноле, железа оксид черный, н-бутиловый спирт, изопропиловый спирт, пропиленгликоль, аммония гидроксид) 5-10 мкг. АТХ: Регистрация: Лекарственное средство П N011415/02 Фармгруппа: противоэпилептическое средство. Дата регистрации: 18.01.2008 / 11.09.2012. Окончание регстрации: . Описание:Капсулы 15 мг: Твердые желатиновые капсулы № 2, состоящие из корпуса белого цвета и прозрачной бесцветной крышечки. На крышечке капсулы имеется надпись "ТОР". На корпусе капсулы имеется надпись "15 mg". Содержимое капсул - гранулы белого или почти белого цвета. Капсулы 25 мг: Твердые желатиновые капсулы № 1, состоящие из корпуса белого цвета и прозрачной бесцветной крышечки. На крышечке капсулы имеется надпись "ТОР". На корпусе капсулы имеется надпись "25 mg". Содержимое капсул - гранулы белого или почти белого цвета. Упаковка:Капсулы, 15 мг и 25 мг. По 28 или 60 капсул во флаконе из полиэтилена высокой плотности. Флакон вместе с инструкцией по медицинскому применению помещают в картонную пачку. Срок годности:2 года. Не применять по истечении срока, указанного на упаковке. Владелец рег.удостоверения:Джонсон &: Джонсон, ООО Производитель:БИОКОМ, ЗАО : CILAG, AG : JANSSEN-CILAG, S.p.A. Представительство:Джонсон &: Джонсон ООО
149 Руб.Регейн пена д/наруж.прим 5% 60г №1

Бренд Регейн Международное непатентованное название Миноксидил Состав 1 г препарата содержит: активное вещество - миноксидил – 47,50 мг*, вспомогательные вещества: этанол безводный – 536,30 мг, вода очищенная – 314,10 мг, бутИЛГидрокситолуол – 0,90 мг**, молочная кислота – 10,00 МГ, Лимонная кислота безводная – 1,00 мг, глицерол – 20,00 мг, цетиловый спирт – 11,00 мг, стеариловый спирт – 5,00 мг, полисорбат 60 – 4,00 мг; пропеллент — пропан/ н-бутан/изобутан (%) (48: 30:22) – 50,20 мг. * Фактическое количество Миноксидила, без пропеллента, составляет 50,00 мг/г; ** Фактическое количество бутилгидрокситолуола, без пропеллента, составляет 1,00 мг/г. Возраст с 18 лет Показания к применению лечение андрогенной алопеции у мужчин и женщин Способ применения и дозы Наружно. Перед применением лекарственного препарата РегейН® волосы и кожа волосистой части головы должны быть тщательно высушены. Для эффективности препарата и его достижения волосяных фолликулов важно наносить препарат на кожу волосистой части головы, а не на волосы. Доза для мужчин: 1 г (половину колпачка) пены наносить 2 раза в сутки (утром и вечером) на пораженные участки волосистой части головы. Не следует применять Регейн® чаще, чем 1 раз в 12 часов. Суммарная суточная доза не должна превышать 2г препарата (100 мГ миноксидила). Доза для женщин: 1г (половину колпачка) пены наносить 1 раз в сутки на пораженные участки волосистой части головы. Не следует применять препарат Регейн® чаще, чем 1 раз в сутки. Суточная доза не должна превышать 1 г препарата (50 мг миноксидила). Не наносить препарат Регейн® на другие участки тела. Рекомендации по использованию баллона: Повернуть колпачок таким образом, чтобы стрелки на распылителе и колпачке находились друг против Наклонив колпачок назад, снять его. Перед выдавливанием пены рекомендуется сначала сполоснуть пальцы холодной водой и тщательно высушить, так как при контакте с теплой кожей пена может раствориться. Перевернув баллон вверх дном, нажать на распылитель и выдавить на пальцы необходимое количество пены Распределить пену кончиками пальцев по участкам облысения и осторожно втереть в кожу волосистой части головы. 6. После использования препарата Регейн® надеть на баллон колпачок. Чтобы сохранить упаковку защищённой от случайного Вскрытия детьми, проверить, чтобы стрелки на распылителе и колпачке не были совмещены. После нанесения препарата Регейн® необходимо тщательно вымыть руки. Появление первых признаков приостановления выпадения волос и восстановления роста волос Возможно после применения лекарственного препарата Регейн® 2 раза в сутки у мужчин в течение 2-4 месяцев и 1 раз в сутки у женщин В течение 3-6 месяцев. Для достижения и поддержания достигнутого эффекта Восстановления роста волос пациент не должен прерывать применение препарата, иначе выпадение волос возобновится. Повышение дозы препарата или более частое его применение не приведет к улучшению результатов терапии. Если после применения лекарственного препарата Регейн® у мужчин в течение 16 недель и у женщин в течение 24 недель усиление роста волос не отмечается, то применение препарата следует прекратить. После начала применения лекарственного препарата Регейн® может отмечаться усиленное выпадение волос. Данный эффект Вызван Влиянием миноксидила. Он Выражается в стимулировании перехода волос из фазы покоя (телоген) в фазу роста (анаген). Таким образом, отмечается Выпадение старых волос, на месте которых вырастают Новые. Временное усиление Выпадения волос обычно продолжается в течение 2-6 недель с момента начала лечения, а затем уменьшается в течение двух недель. Область применения Наружно. Перед применением лекарственного препарата Регейн® волосы и кожа волосистой части головы должны быть тщательно высушены. Для эффективности препарата и его достижения волосяных фолликулов важно наносить препарат на кожу волосистой части головы, а не на волосы. Доза для мужчин: 1 г (половину колпачка) аэрозоля наносить 2 раза в сутки (утром и вечером) на пораженные участки волосистой части головы. Не следует применять Регейн® чаще, чем 1 раз в 12 часов. Суммарная суточная доза не должна превышать 2 г препарата (100 мг миноксидила). Доза для женщин: 1 г (половину колпачка) аэрозоля наносить 1 раз в сутки на пораженные участки волосистой части головы. Не следует применять препарат Регейн® чаще, чем 1 раз в сутки. Суточная доза не должна превышать 1 г препарата (50 мг миноксидила). Не наносить препарат Регейн® на другие участки тела. Меры предосторожности Рекомендации по применению лекарственного препарата совместно со средствами по уходу за волосами: Лекарственный препарат не будет эффективен при использовании: фена после нанесения аэрозоля на кожу головы; средств по уходу за волосами, которые могут вызвать образование рубцов, а также глубокие ожоги кожи головы; методов ухода за волосами, требующих сильного оттягивания волос от кожи головы (например, плетение «тугих» кос (брейдинг) или прическа «конский хвост»). Для нанесения лекарственного препарата нет необходимости в мытье головы. В случае мытья головы перед применением лекарственного препарата, необходимо высушить волосы и кожу головы. При использовании средств для укладки волос необходимо сначала нанести аэрозоль и дождаться, пока он высохнет, а затем использовать средства для укладки волос. Мытье головы допускается не менее чем через 4 часа после нанесения лекарственного препарата. Данных о влиянии окрашивания, химической завивки, распрямителей для волос на эффективность лекарственного препарата нет. Поскольку химическая завивка и окрашивание могут вызывать раздражение кожи головы, рекомендованы следующие меры предосторожности: До окрашивания и/или химической завивки необходимо убедиться, что лекарственный препарат был смыт с волос и кожи головы, чтобы избежать возможного раздражения кожи головы. Для достижения наилучших результатов не следует наносить лекарственный препарат в один день с химической обработкой волос. После использования каких-либо химических веществ не наносить лекарственный препарат в течение 24 часов, чтобы убедиться, что кожа головы не раздражена после химической завивки и/или окрашивания. Перед тем как начать лечение препаратом Регейн®, пациенты должны пройти общее обследование, включающее сбор и изучение медицинского анамнеза. Врач должен убедиться в том, что кожа волосистой части головы здорова. Наносить лекарственный препарат Регейн® следует только на здоровую кожу волосистой части головы. Нельзя использовать его при воспалении, инфицировании, раздражении, болезненности кожи, а также одновременно с другими лекарственными препаратами, наносимыми на кожу волосистой части головы. Не следует применять лекарственный препарат Регейн® в случаях внезапного выпадения волос, очаговой алопеции, когда алопеция развивается после родов, в случае облысения, вызванного приемом лекарственных средств, неправильным питанием (дефицит железа, витамина А), в результате укладки волос в «тугие» прически, а также в том случае, когда причина выпадения волос неизвестна. При появлении снижения артериального давления или боли в грудной клетке, учащенного сердцебиения, слабости или головокружения, внезапного необъяснимого увеличения массы тела, отека кистей или стоп, стойкого покраснения или раздражения кожи волосистой части головы следует прекратить применение препарата Регейн® и обратиться к врачу. Некоторые компоненты препарата могут вызывать жжение и раздражение. В случае попадания препарата на чувствительные поверхности (глаза, раздраженную кожу, слизистые оболочки) необходимо промыть пораженный участок большим количеством прохладной воды. Препарат содержит бутилгидрокситолуол, цетиловый и стеариловый спирт, которые могут вызвать местные кожные реакции (например, контактный дерматит). Случайный прием препарата внутрь может привести к развитию серьезных нежелательных явлений со стороны сердца. Поэтому данный препарат следует хранить в местах, недоступных для детей. Содержимое аэрозольного баллона находится под давлением. Не прокалывать и не сжигать аэрозольный баллон. Препарат легко воспламеняется, поэтому не следует распылять содержимое аэрозольного баллона вблизи открытого огня, полированных или окрашенных поверхностей. Следует избегать контакта аэрозольного баллона с источниками открытого огня при использовании, хранении и утилизации. Не нагревать баллон выше 50 °С. При нанесении препарата следует воздержаться от курения. Если лекарственное средство пришло в негодность или истек срок годности – не выливайте его в сточные воды и не выбрасывайте на улицу! Поместите лекарственное средство в пакет и положите в мусорный контейнер. Эти меры помогут защитить окружающую среду! Код АТХ D11AX01 Лекарственная форма пена для наружного применения Действующие вещества миноксидил – 47,50 мг Вспомогательные вещества этанол безводный – 536,30 мг, вода очищенная – 314,10 мг, бутилгидрокситолуол – 0,90 мг**, молочная кислота – 10,00 мг, лимонная кислота безводная – 1,00 мг, глицерол – 20,00 мг, цетиловый спирт – 11,00 мг, стеариловый спирт – 5,00 мг, полисорбат 60 – 4,00 мг; пропеллент – пропан/н-бутан/изобутан (%) (48 : 30 : 22) – 50,20 мг Фармакологическая группа средство лечения алопеции Фармакодинамика Являясь периферическим вазодилататором, миноксидил при наружном применении усиливает микроциркуляцию в области волосяных фолликулов. Миноксидил стимулирует фактор роста эндотелия сосудов (ФРЭС), который, как предполагается, ответственен за повышение проницаемости капилляров, что свидетельствует о высокой метаболической активности, наблюдаемой в фазе анагена. Миноксидил стимулирует рост волос у пациентов с наследственной потерей волос (андрогенная алопеция) в начальной и умеренной стадии. Точный механизм действия миноксидила для наружного применения при Выпадении волос до конца не изучен. Фармакокинетика Всасывание. При наружном применении на неповрежденную кожу приблизительно 1-2 % раствора Миноксидила подвергается системной абсорбции. В клиническом исследований Системная абсорбция 5 % пены для наружного применения составила приблизительно половину от системной абсорбции 5 % раствора для наружного применения. Средние значения площади под кривой «концентрация-время» AUC (0-12 ч) и максимальной концентрации (Cmax) при применении 5 % пены составили 8.81 нг×ч/мл и 1,11 нг/мл, соответственно, что соответствует приблизительно 50 % аналогичных показателей при использовании 5 % раствора (18,71 нг×ч/мл и 2,13 нг/мл. соответственно). Время до достижения максимальной концентрации миноксидила (TCmax) при применении 5 % пены составляет 5,42 ч сходно с таковым при применении 5 % раствора (5,79 ч). Влияние Миноксидила на гемодинамику не выражено до тех пор, пока средняя сывороточная концентрация Миноксидила не достигнет 21,7 нг/мл. Распределение. Хотя ранее сообщалось о том, что Миноксидил не связывается с белками Плазмы, позднее методом ультрафильтрации in vitro было продемонстрировано его обратимое связывание с белками плазмы крови человека в диапазоне 37-39 %. Поскольку абсорбируется только 1-2 % нанесенного наружно Миноксидила, Степень его связыания с белками плазмы, отмечающегося іn vivo после наружного нанесения, будет Клинически незначимой. Объем распределения миноксидила после Внутривенного введения в дозе 4,6 мг и 18,4 мг составляет 73,1 ли 69,2 л, соответственно. Метаболизм. Примерно 60 % миноксидила, абсорбировавшегося после наружного применения, метаболизируется с образованием миноксидила люкуронида, преимущественно в печени. Выведение. Период полувыведения миноксидила для наружного применения в среднем составляет 22 ч, по сравнению с 1,49 ч при пероральном применении. 97% миноксидила и его метаболитов экскретируются почками и 3 % — через кишечник. После прекращения применения препарата примерно 95 % миноксидила, нанесенного наружно, выводится в течение 4-х дней. Противопоказания Повышенная чувствительность к Миноксидилу или другим компонентам препарата; • нарушение целостности кожных покровов; • дерматозы волосистой части головы; • одновременное применение других лекарственных средств на коже головы; • беременность; • период грудного вскармливания; • Возраст: младше 18 лет и старше 65 лет. Применение при беременности и в период кормления грудью Препарат Регейн® в виде пены противопоказан женщинам во время беременности и в период грудного вскармливания. Пациентам, которым следуют принимать с осторожностью Пациентам с сердечнососудистыми заболеваниями и аритмией, почечной и печеночной недостаточностью перед началом лечения препаратом Регейн® необходимо проконсультироваться с врачом. Побочное действие Частота побочных реакций приведена в виде следующей градации: очень часто (>1/10); часто (21/100, 1/1000
1818 Руб.Показания Контрацепция. Противопоказания Противопоказания Препарат Ярина® противопоказан при наличии любого из состояний/заболеваний, перечисленных ниже. Если какие-либо из этих состояний/заболеваний развиваются впервые на фоне приема, препарат должен быть немедленно отменен- тромбозы (венозные и артериальные) и тромбоэмболии (в том числе тромбоз глубоких вен, тромбоэмболия легочной артерии, инфаркт миокарда, инсульт), цереброваскулярные нарушения - в настоящее время или в анамнезе- состояния, предшествующие тромбозу (в том числе транзиторные ишемические атаки, стенокардия) в настоящее время или в анамнезе- выявленная приобретенная или наследственная предрасположенность к венозному или артериальному тромбозу, включая резистентность к активированному протеину С, дефицит антитромбина III, дефицит протеина С, дефицит протеина S, гипергомоцистеинемия, антитела к фосфолипидам (антитела к кардиолипину, волчаночный антикоагулянт)- наличие высокого риска венозного или артериального тромбоза (смотри раздел "Особые указания")- мигрень с очаговыми неврологическими симптомами в настоящее время или в анамнезе- сахарный диабет с сосудистыми осложнениями- панкреатит с выраженной гипертриглицеридемией в настоящее время или в анамнезе- печеночная недостаточность и тяжелые заболевания печени (до нормализации печеночных проб)- опухоли печени (доброкачественные или злокачественные) в настоящее время или в анамнезе- тяжелая или острая почечная недостаточность: - выявленные гормонозависимые злокачественные заболевания (в том числе половых органов или молочных желез) или подозрение на них- кровотечение из влагалища неясного генеза- беременность или подозрение на нее- период грудного вскармливания- повышенная чувствительность к любому из компонентов препарата Ярина®: - непереносимость лактозы, дефицит лактазы, глюкозо-галактозная мальабсорбция (в состав препарата входит лактозы моногидрат). С осторожностью: Следует тщательно взвешивать потенциальный риск и ожидаемую пользу применения КОК в каждом индивидуальном случае при наличии следующих заболеваний/состояний и факторов риска- факторы риска развития тромбоза и тромбоэмболий: курение: ожирение: дислипопротеинемия, контролируемая артериальная гипертензия: мигрень без очаговой неврологической симптоматики: пороки клапанов сердца: наследственная предрасположенность к тромбозу (тромбозы, инфаркт миокарда или нарушение мозгового кровообращения в молодом возрасте у кого-либо из ближайших родственников)- другие заболевания, при которых могут отмечаться нарушения периферического кровообращения: сахарный диабет: системная красная волчанка: гемолитико-уремический синдром: болезнь Крона и язвенный колит: серповидно-клеточная анемия: флебит поверхностных вен- наследственный ангионевротический отек- гипертриглицеридемия- заболевания печени, не относящиеся к противопоказаниям (см. "Противопоказания")- заболевания, впервые возникшие или усугубившиеся во время беременности или на фоне предыдущего приема половых гормонов (например, желтуха и/или зуд, связанные с холестазом, холелитиаз, отосклероз с ухудшением слуха, порфирия, герпес во время беременности, хорея Сиденгама): - послеродовый период. Беременность Препарат Ярина® противопоказан во время беременности и в период грудного вскармливания. Если беременность выявляется во время приема препарата Ярина®, препарат следует сразу же отменить. Обширные эпидемиологические исследования не выявили повышенного риска дефектов развития у детей, рожденных женщинами, получавшими половые гормоны до беременности или тератогенного действия в случаях приема половых гормонов по неосторожности в ранние сроки беременности. В то же время имеющиеся данные о применении препарата Ярина® во время беременности ограничены, что не позволяет сделать какие-либо выводы о негативном влиянии препарата на беременность, здоровье плода и новорожденного ребенка. В настоящее время какие-либо значимые эпидемиологические данные отсутствуют. Прием препарата может уменьшать количество грудного молока и изменять его состав, поэтому применение препарата противопоказано до прекращения грудного вскармливания. Небольшое количество половых гормонов и/или их метаболитов может проникать в грудное молоко и оказывать влияние на здоровье ребенка. Применение и дозы Как и когда принимать таблетки Календарная упаковка препарата Ярина® содержит 21 таблетку. Каждая таблетка в упаковке маркируется днем недели, в который она должна быть принята. Таблетки следует принимать внутрь каждый день в течение 21 дня по порядку, указанному на упаковке, примерно в одно и то же время, запивая небольшим количеством воды. Прием таблеток из следующей упаковки начинается после 7-дневного перерыва, во время которого обычно развивается менструальноподобное кровотечение (кровотечение "отмены"). Как правило, оно начинается на 2-3 день после приема последней таблетки и может не закончиться до начала приема таблеток из новой упаковки. После 7-дневного перерыва начать прием таблеток из новой упаковки необходимо даже в случае, если менструальноподобное кровотечение еще не прекратилось. Это означает, что начинать прием таблеток из новой упаковки необходимо в один и тот же день недели, и что каждый месяц кровотечение "отмены" будет наступать примерно в один и тот же день недели. Прием таблеток из первой упаковки препарата Ярина® - Когда никакое гормональное противозачаточное средство не применялось в предыдущем месяце Прием препарата Ярина® следует начать в первый день менструального цикла (т.е. в первый день менструального кровотечения). Необходимо принять таблетку, которая промаркирована соответствующим днем недели. Затем следует принимать таблетки по порядку. Допускается начать прием препарата на 2-5 день менструального цикла, но в этом случае в течение первых 7 дней приема таблеток из первой упаковки рекомендуется дополнительно использовать барьерный метод контрацепции. - При переходе с других комбинированных контрацептивных препаратов (КОК, вагинального кольца или трансдермального пластыря) Предпочтительно начать прием препарата Ярина® на следующий день после приема последней активной таблетки из предыдущей упаковки, но ни в коем случае не позднее следующего дня после обычного 7-дневного перерыва (для препаратов, содержащих 21 таблетку) или после приема последней неактивной таблетки (для препаратов, содержащих 28 таблеток в упаковке). Прием препарата Ярина® следует начинать в день удаления вагинального кольца или пластыря, но не позднее дня, когда должно быть введено новое кольцо или наклеен новый пластырь. - При переходе с контрацептивов, содержащих только гестагены ("мини-пили", инъекционные формы, имплантат) или с внутриматочной терапевтической системы с высвобождением гестагена Перейти с "мини-пили" на препарат Ярина® можно в любой день (без перерыва), с имплантата или внутри маточного контрацептива с гестагеном - в день их удаления, с инъекционной формы - в день, когда должна быть сделана следующая инъекция. Во всех этих случаях в течение первых 7 дней приема таблеток препарата Ярина® необходимо дополнительно использовать барьерный метод контрацепции (например, презерватив). - После аборта (в том числе самопроизвольного) в первом триместре беременности Начать прием препарата можно немедленно. При соблюдении этого условия дополнительных мер контрацепции не требуется- После родов (при отсутствии грудного вскармливания) или аборта (в том числе самопроизвольного) во втором триместре беременности. Начать прием препарата рекомендуется на 21-28 день после родов (при отсутствии грудного вскармливания) или аборта во втором триместре беременности. Если прием препарата начат позднее, необходимо использовать дополнительно барьерный метод контрацепции в течение первых 7 дней приема таблеток. Если половой контакт имел место до начала приема препарата Ярина®, необходимо исключить беременность. Прием пропущенных таблеток. Если опоздание в приеме препарата составило менее 12 часов, контрацептивная защита не снижается. Нужно принять пропущенную таблетку как можно скорее, следующая таблетка принимается в обычное время. Если опоздание в приеме таблеток составило более 12 часов, контрацептивная защита снижается. Чем больше таблеток пропущено, и чем ближе пропуск к 7-дневному перерыву в приеме таблеток, тем выше вероятность наступления беременности. При этом необходимо помнить- Прием препарата никогда не должен быть прерван более чем на 7 дней- 7 дней непрерывного приема таблеток требуется для достижения адекватного подавления гипоталамо-гипофизарно-яичниковой системы. Соответственно, если опоздание в приеме таблеток превышает 12 часов (интервал с момента приема последней таблетки - более 36 часов), в зависимости от недели, когда пропущена таблетка, необходимо: Первая неделя приема препарата. Необходимо принять последнюю пропущенную таблетку как можно скорее, как только женщина вспомнит об этом (даже если для этого нужно принять две таблетки одновременно). Следующую таблетку необходимо принять в обычное время. В течение последующих 7 дней дополнительно должен быть использован барьерный метод контрацепции (например, презерватив). Если половой контакт имел место в течение 7 дней перед пропуском таблетки, необходимо учесть возможность наступления беременности. Вторая неделя приема препарата. Необходимо принять последнюю пропущенную таблетку как можно скорее, как только женщина вспомнит об этом (даже если для этого нужно принять две таблетки одновременно). Следующую таблетку необходимо принять в обычное время. При условии, если женщина принимала таблетки правильно в течение предшествующих 7 дней, нет необходимости в использовании дополнительных контрацептивных мер. В противном случае, а также при пропуске двух и более таблеток, необходимо дополнительно использовать барьерные методы контрацепции (например, презерватив) в течение последующих 7 дней. Третья неделя приема препарата. Риск снижения контрацептивной надежности неизбежен из-за предстоящего перерыва в приеме таблеток. В этом случае необходимо придерживаться следующих алгоритмов- если в течение 7 дней, предшествующих первой пропущенной таблетке, все таблетки принимались правильно, нет необходимости использовать дополнительные методы контрацепции. При приеме пропущенных таблеток руководствуйтесь пунктами 1 или 2- если в течение 7 дней, предшествующих первой пропущенной таблетке, таблетки принимались неправильно, то в течение последующих 7 дней необходимо дополнительно использовать барьерный метод контрацепции (например, презерватив) и в этом случае следует руководствоваться пунктом 1 для приема пропущенных таблеток.1. Необходимо принять пропущенную таблетку как можно скорее, как только женщина вспомнит об этом (даже если это означает прием двух таблеток одновременно). Следующие таблетки принимают в обычное время, пока не закончатся таблетки из текущей упаковки. Прием таблеток из следующей упаковки следует начать сразу же без обычного 7-дневного перерыва. Кровотечение "отмены" маловероятно, пока не закончатся таблетки из второй упаковки, но могут отмечаться "мажущие" выделения и/или "прорывные" кровотечения в дни приема препарата.2. Можно также прервать прием таблеток из текущей упаковки, сделать перерыв на 7 или менее дней (включай дни пропуска таблеток), после чего начать прием таблеток из новой упаковки. Если женщина пропустила прием таблеток, а во время перерыва в приеме у нее нет кровотечения "отмены", необходимо исключить беременность (см. рис.). Допускается принимать не более двух таблеток в один день. Рекомендации при желудочно-кишечных расстройствах. При тяжелых желудочно-кишечных расстройствах всасывание препарата может быть неполным, поэтому следует использовать дополнительные методы контрацепции. Если в течение 3-4 часов после приема таблеток отмечается рвота или диарея, в зависимости от недели приема препарата следует ориентироваться на рекомендации при пропуске таблеток, указанные выше. Если женщина не хочет менять свою обычную схему приема и переносить начало менструации на другой день недели, дополнительную таблетку следует принять из другой упаковки. Прекращение приема препарата Ярина®Прием препарата Ярина® можно прекратить в любое время. Если женщина не планирует беременность, следует позаботиться о других методах контрацепции. Если планируется беременность, следует просто прекратить прием препарата Ярина® и подождать естественного менструального кровотечения. Отсрочка начала менструальноподобного кровотечения. Для того, чтобы отсрочить начало менструальноподобного кровотечения, необходимо продолжить дальнейший прием таблеток из новой упаковки препарата Ярина® без 7-дневного перерыва. Таблетки из новой упаковки могут приниматься так долго, как это необходимо, в том числе до тех пор, пока таблетки в упаковке не закончатся. На фоне приема препарата из второй упаковки могут отмечаться "мажущие" кровянистые выделения из влагалища и/или "прорывные" маточные кровотечения. Возобновить прием препарата Ярина® из очередной упаковки следует после обычного 7-дневного перерыва. Изменение дня начала менструальноподобного кровотечения. Для того чтобы перенести день начала менструальноподобного кровотечения на другой день недели, женщине следует сократить (но не удлинять) ближайший 7-дневный перерыв в приеме таблеток на столько дней, на сколько женщина хочет. Например, если цикл обычно начинается в пятницу, а в будущем женщина хочет, чтобы он начинался во вторник (3 днями ранее), прием таблеток из следующей упаковки необходимо начать на 3 дня раньше, чем обычно. Чем короче перерыв в приеме таблеток, тем выше вероятность, что менструальноподобное кровотечение не наступит, и во время приема таблеток из второй упаковки будут наблюдаться "мажущие" выделения и/или "прорывные" кровотечения. Применение у отдельных групп пациентокУ детей и подростков. Препарат Ярина® показан только после наступления менархе. Имеющиеся данные не предполагают коррекции дозы у данной группы пациенток.У пожилых. Не применимо. Препарат Ярина® не показан после наступления менопаузы. При нарушениях функции печени. Препарат Ярина® противопоказан к применению у женщин с тяжелыми заболеваниями печени до тех пор, пока показатели функции печени не придут в норму. См. также раздел "Противопоказания" и "Фармакологические свойства". При нарушениях функции почек Препарат Ярина® противопоказан женщинам с тяжелой почечной недостаточностью или с острой почечной недостаточностью. См. также разделы "Противопоказания" и "Фармакологические свойства". Побочные эффекты и передозировка Побочные эффекты: Данные о частоте возникновения побочных реакций, о которых сообщалось в ходе клинических исследований препарата Ярина® (N=4897), приведены в таблице ниже. В пределах каждой группы, выделенной в зависимости от частоты возникновения, побочные реакции представлены в порядке уменьшения их тяжести. По частоте они разделяются на частые (>:1/100 и <:1/10), нечастые (>:1/1000 и <:1/100) и редкие (>:1/10000 и <:1/1000). Для дополнительных побочных реакций, выявленных только в процессе постмаркетинговых исследований, и для которых оценку частоты возникновения провести не представлялось возможным, указано "частота неизвестна". ТАБЛИЦЪ Нежелательные явления в ходе клинических исследований были кодифицированы с использованием словаря MedDRA (Медицинский Словарь Регуляторной Деятельности, версия 12.1). Различные термины MedDRA, отражающие один и тот же симптом, были сгруппированы вместе и представлены в качестве единственной побочной реакции, во избежание ослабления или размытия истинного эффекта. * Расчетная частота по данным эпидемиологических исследований, охватывавших группу КОК. Венозные и артериальные тромбоэмболические осложнения объединяют следующие нозологические формы: окклюзия периферических глубоких вен, тромбоз и тромбоэмболия /окклюзия легочных сосудов, тромбоз, эмболия и инфаркт /инфаркт миокарда/церебральный инфаркт и инсульт не классифицированный как геморрагический. Для венозной и артериальном тромбоэмболии, мигрени см. также "Противопоказания" и "Особые указания". Ниже перечислены побочные реакции с очень низкой частотой возникновения или с отсроченным развитием симптомов, которые считаются связанными с группой КОК (см. также разделы "Противопоказания”, “Особые указания"): Опухоли - У женщин, применяющих КОК, очень незначительно повышена частота выявления рака молочной железы. Поскольку рак молочной железы редко встречается у женщин моложе 40 лет, повышение частоты рака у женщин, применяющих КОК, незначительно по отношению к общему риску возникновения рака молочной железы. Причинно-следственная связь с применением КОК неизвестна. - Опухоли печени (доброкачественные и злокачественные). Прочие состояния - Узловатая эритема. - Женщины с гипертриглицеридемией (повышенный риск панкреатита при применении КОК). - Повышение артериального давления. - Наступление или ухудшение состояний, при которых связь с применением КОК не является неоспоримой: желтуха и/или зуд, связанные с холестазом: образование камней желчного пузыря: порфирия: системная красная волчанка: гемолитико-уремический синдром: хорея Сиденгама: герпес во время беременности: потеря слуха, связанная с отосклерозом. - У женщин с наследственным ангионевротическим отеком экзогенные эстрогены могут вызвать или усилить симптомы ангионевротического отека. - Нарушения функции печени. - Нарушения толерантности к глюкозе или влияние на периферическую инсулинорезистентность. - Болезнь Крона, язвенный колит- Хлоазма- Гиперчувствительность (включая такие симптомы как сыпь, крапивница). Взаимодействие Вследствие взаимодействия других препаратов (индукторов ферментов) с пероральными контрацептивами могут возникать "прорывные" кровотечения и/или снижение контрацептивного эффекта (см. раздел "Взаимодействие с другими лекарственными препаратами"). Передозировка: О серьезных нарушениях при передозировке не сообщалось. На основании суммарного опыта применения КОК симптомы, которые могут отмечаться при передозировке: тошнота, рвота, мажущие кровянистые выделения из влагалища, метроррагия. Специфического антидота нет, следует проводить симптоматическое лечение. Взаимодействие с другими ЛС: Влияние других лекарственных средств на препарат Ярина®Возможно взаимодействие с лекарственными средствами, индуцирующими микросомальные ферменты печени, в результате чего может увеличиваться клиренс половых гормонов, что, в свою очередь, может приводить к "прорывным" маточным кровотечениям и/или снижению контрацептивного эффекта. Женщинам, которые получают лечение такими препаратами в дополнение к препарату Ярина®, рекомендуется использовать барьерный метод контрацепции или выбрать иной негормональный метод контрацепции. Барьерный метод контрацепции следует использовать в течение всего периода приема сопутствующих препаратов, а также в течение 28 дней после их отмены. Если период применения барьерного метода контрацепции заканчивается позже, чем таблетки в упаковке препарата Ярина®, следует начать прием таблеток препарата Ярина® из новой упаковки без перерыва в приеме таблеток- Вещества, увеличивающие клиренс препарата Ярина® (ослабляющие эффективность путем индукции ферментов): фенитоин, барбитураты, примидон, карбамазепин, рифампицин и, возможно, также окскарбазепин, топирамат, фелбамат, гризеофульвин, а также препараты, содержащие зверобой продырявленный- Вещества с различным влиянием на клиренс препарата Ярина®При совместном применении с препаратом Ярина® многие ингибиторы протеаз ВИЧ или вируса гепатита С и ненуклеозидные ингибиторы обратной транскриптазы могут как увеличивать, так и уменьшать концентрацию эстрогенов или прогестинов в плазме крови. В некоторых случаях такое влияние может быть клинически значимо- Вещества, снижающие клиренс КОК (ингибиторы ферментов)Сильные и умеренные ингибиторы CYP3A4, такие как азольные антимикотики (например, итраконазол, вориконазол, флюконазол), верапамил, макролиды (например, кларитромицин, эритромицин), дилтиазем и грейпфрутовый сок могут повышать плазменные концентрации эстрогена или прогестина, или их обоих. Было показано, что эторикоксиб в дозах 60 и 120 мг/сутки при совместном приеме с КОК, содержащими 0,035 мг этинилэстрадиола, повышает концентрацию этинилэстрадиола в плазме крови в 1,4 и 1,6 раза соответственно. Влияние препарата Ярина® на другие лекарственные препаратыКОК могут влиять на метаболизм других препаратов, что приводит к повышению (например, циклоспорин) или снижению (например, ламотриджин) их концентрации в плазме крови и тканях. In vitro дроспиренон способен слабо или умеренно ингибировать ферменты цитохрома Р450 CYP1A1, CYP2C9, CYP2C19 и CYP3A4. На основании исследований взаимодействия in vivo у женщин-добровольцев, принимавших омепразол, симвастатин или мидазолам в качестве маркерных субстратов, можно заключить, что клинически значимое влияние 3 мг дроспиренона на метаболизм лекарственных препаратов, опосредованный ферментами цитохрома Р450, маловероятно. In vitro этинилэстрадиол является обратимым ингибитором CYP2C19, CYP1A1 и CYP1A2, а также необратимым ингибитором CYP3A4/5, CYP2C8 и CYP2J2. В клинических исследованиях назначение гормонального контрацептива, содержащего этинилэстрадиол, не приводило к какому-либо повышению или приводило лишь к слабому повышению концентраций субстратов CYP3A4 в плазме крови (например, мидазолама), в то время как плазменные концентрации субстратов CYP1A2 могут возрастать слабо (например, теофиллин) или умеренно (например, мелатонин и тизанидин). Другие формы взаимодействия У пациенток с ненарушенной функцией почек сочетанное применение дроспиренона и ингибиторов ангиотензинпревращающего фермента или нестероидных противовоспалительных препаратов не оказывает значимого эффекта на концентрацию калия в плазме крови. Тем не менее сочетанное применение препарата Ярина® с антагонистами альдостерона или калийсберегающими диуретиками не изучено. При совместном приеме с данными препаратами концентрацию калия в плазме крови необходимо контролировать в течение первого цикла приема (см. раздел "Особые указания"). Фармакологическое действие и фармакокинетика Препарат Ярина® - низкодозированный монофазный пероральный комбинированный эстроген-гестагенный контрацептивный препарат. Контрацептивный эффект препарата Ярина® осуществляется в основном посредством взаимодополняющих механизмов, к наиболее важным из которых относятся подавление овуляции и повышение вязкости секрета шейки матки, в результате чего она становится непроницаемой для сперматозоидов. При правильном применении препарата Ярина® индекс Перля (показатель, отражающий число беременностей у 100 женщин, применяющих контрацептив в течение года) составляет менее 1. При пропуске таблеток или неправильном применении индекс Перля может возрастать. Повышенный риск венозной тромбоэмболии (ВТЭ), связываемый с применением комбинированных пероральных контрацептивов (КОК), относится, прежде всего, к эстрогенному компоненту. В настоящее время продолжаются научные споры относительно модулирующего эффекта прогестина, входящего в состав КОК, в отношении риска ВТЭ. Сравнительные эпидемиологические исследования риска ВТЭ при применении КОК, содержащих этинилэстрадиол/дроспиренон, и риска при применении левоноргестрел-содержащих КОК показали различные результаты - от отсутствия отличий по степени риска, до трехкратного возрастания риска. В большинстве исследований изучался препарат Ярина®. Для оценки риска ВТЭ при применении препарата Ярина® (этинилэстрадиол/дроспиренон в дозах 0,03 мг/3 мг) были проведены два пострегистрационных исследования. Первое проспективное наблюдательное исследование показало, что частота возникновения ВТЭ у женщин, применяющих препарат Ярина®, при наличии или в отсутствии других факторов риска ВТЭ была в том же диапазоне, что и для женщин, применяющих левоноргестрел-содержащие и другие КОК. Второе проспективное контролируемое исследование баз данных, в ходе которого проводилась сравнительная оценка женщин, применяющих препарат Ярина®, с женщинами, применяющими другие КОК, также подтвердило сходную частоту ВТЭ среди всех когорт женщин.У женщин, принимающих КОК, цикл становится более регулярным, реже наблюдаются болезненные менструальноподобные кровотечения, уменьшается интенсивность и продолжительность кровотечения, в результате чего снижается риск железодефицитной анемии. Также имеются данные о снижении риска рака эндометрия и яичников при приеме КОК. Дроспиренон, входящий в состав препарата Ярина®, обладает атиминералокортикоидной активностью и способен предупреждать увеличение массы тела и появление других симптомов (например, отеков), связанных с эстрогензависимой задержкой жидкости. Дроспиренон также обладает антиандрогенной активностью и способствует уменьшению угрей (акне), жирности кожи и волос (себореи). Эти особенности дроспиренона следует учитывать при выборе контрацептива женщинам с гормонозависимой задержкой жидкости, а также женщинам с акне и себореей. По своим характеристикам дроспиренон схож с естественным прогестероном, вырабатываемым женским организмом. Фармакокинетика: Дроспиренон Абсорбция При приеме внутрь дроспиренон быстро и почти полностью абсорбируется. После однократного приема максимальная концентрация (Сmax) дроспиренона в плазме крови, равная 38 нг/мл, достигается через 1-2 часа. Прием пищи не влияет на биодоступность, которая колеблется в диапазоне от 76 до 85%. Распределение Дроспиренон связывается с альбумином плазмы крови и не связывается с глобулином, связывающим половые гормоны (ГСПГ), или кортикостероид-связывающим глобулином (КСГ). Лишь 3-5% от общей концентрации вещества в плазме крови присутствует в виде свободного гормона, 95-97% вещества неспецифически связываются с альбумином. Индуцированное этинилэстрадиолом повышение ГСПГ не влияет на связывание дроспиренона белками плазмы крови. Средний кажущийся объем распределения составляет 3,7±1,2 л/кг. Метаболизм После перорального приема дроспиренон полностью метаболизируется. Большинство метаболитов в плазме крови представлены кислотными формами дроспиренона. Дроспиренон также является субстратом для окислительного метаболизма, катализируемого изоферментом СYР 3А4. Скорость метаболического клиренса дроспиренона из плазмы крови составляет 1,5±0,2 мл/мин/кг. Выведение Концентрация дроспиренона в плазме крови снижается двухфазно. Вторая, окончательная фаза имеет период полувыведения (T1/2) около 31 часа. В неизмененной форме дроспиренон экскретируется в следовых количествах. Его метаболиты выводятся через желудочно-кишечный тракт и почками в соотношении примерно 1,2:1.4. Период полувыведения метаболитов дроспиренона составляет примерно 40 часов. Равновесная концентрация Концентрация ГСПГ не оказывает влияния на показатели фармакокинетики дроспиренона. При ежедневном применении препарата внутрь концентрация дроспиренона в плазме крови повышается в 2-3 раза, равновесная концентрация достигается через 8 дней приема препарата. При нарушении функции почек Исследования показали, что концентрация дроспиренона в плазме крови женщин с легким нарушением функции почек (клиренс креатинина (КК) - 50-80 мл/мин) при достижении равновесного состояния и у женщин с сохранной функцией почек (КК - более 80 мл/мин) сопоставимы. Тем не менее у женщин с умеренным нарушением функции почек (КК - 30-50 мл/мин) средняя концентрация дроспиренона в плазме крови была на 37% выше, чем у пациенток с сохранной функцией почек. Не отмечено изменения концентрации калия в плазме крови при применении дроспиренона. При нарушении функции печени У женщин с умеренным нарушением функции печени (класс В по шкале Чайлд-Пью) площадь под кривой "концентрация-время" (AUC) сопоставима с соответствующим показателем у здоровых женщин с близкими значениями Сmax в фазе абсорбции и распределения. Т1/2 дроспиренона у больных с умеренным нарушением функции печени оказался в 1,8 раз выше, чем у здоровых добровольцев. У больных с умеренным нарушением функции печени отмечено снижение клиренса дроспиренона приблизительно на 50% по сравнению со здоровыми женщинами, при этом не отмечено различий в концентрации калия в плазме крови в изучаемых группах. При выявлении сахарного диабета и сопутствующем применении спиронолактона (оба состояния расцениваются как факторы, предрасполагающие к развитию гиперкалиемии) повышения концентрации калия в плазме крови не установлено. Таким образом, можно заключить, что переносимость дроспиренона у женщин с легким и умеренным нарушением функции печени хорошая (класс В по шкале Чайлд-Пью). Этническая принадлежность Не установлено влияния этнической принадлежности (исследование проведено на когортах женщин европеоидной расы и японок) на параметры фармакокинетики дроспиренона и этинилэстрадиола. Этинилэстрадиол Абсорбция После приема внутрь этинилэстрадиол быстро и полностью абсорбируется. Сmax - 100 нг/мл достигается в течение 1-2 часов. Во время всасывания и "первого прохождения" через печень этинилэстрадиол метаболизируется, в результате чего его биодоступность при приеме внутрь составляет в среднем около 45% при высокой межиндивидуальной вариабельности - от 20 до 65%. Одновременный прием пищи в отдельных случаях сопровождается снижением биодоступности этинилэстрадиола на 25%. Распределение Этинилэстрадиол неспецифически, но прочно связывается с альбумином плазмы крови (около 98%) и индуцирует повышение концентрации в плазме крови ГСПГ. Предполагаемый объем распределения составляет 5 л/кг. Метаболизм Этинилэстрадиол подвергается значительному первичному метаболизму в кишечнике и печени. Этинилэстрадиол и его окислительные метаболиты первично конъюгированы с глюкуронидами или сульфатом. Скорость метаболического клиренса этинилэстрадиола составляет около 5 мл/мин/кг. Выведение Снижение концентрации этинилэстрадиола в плазме крови носит двухфазный характер: первая фаза характеризуется периодом полувыведения около 1 часа, вторая - 20 часов. Этинилэстрадиол практически не выводится в неизмененном виде. Метаболиты этинилэстрадиола выводятся почками и через кишечник в соотношении 4:6. Период полувыведения метаболитов составляет примерно 24 ч. Равновесная концентрация Равновесное состояние достигается во второй половине цикла приема препарата, когда концентрация этинилэстрадиола в плазме крови повышается на 40-110% по сравнению с применением разовой дозы. Особые указания Если какие-либо из состояний, заболеваний и факторов риска, указанных ниже, имеются в настоящее время, то следует тщательно взвешивать потенциальный риск и ожидаемую пользу применения препарата Ярина® в каждом индивидуальном случае и обсудить его с женщиной до того, как она решит начать прием препарата. В случае утяжеления, усиления или первого проявления любого из этих состояний, заболеваний или факторов риска, женщина должна проконсультироваться со своим врачом, который может принять решение о необходимости отмены препарата. Заболевания сердечно-сосудистой системы. Результаты эпидемиологических исследований указывают на наличие взаимосвязи между применением КОК и повышением частоты развития венозных и артериальных тромбозов и тромбоэмболий (таких как тромбоз глубоких вен, тромбоэмболия легочной артерии, инфаркт миокарда, цереброваскулярные нарушения) при приеме КОК. Данные заболевания отмечаются редко. Риск развития ВТЭ максимален в первый год приема КОК. Повышенный риск присутствует после первоначального применения КОК или возобновления применения одного и того же или другого КОК (после перерыва между приемами препарата в 4 недели и более). Данные крупномасштабного проспективного исследования с участием 3 групп пациенток показывают, что этот повышенный риск присутствует преимущественно в течение первых 3 месяцев. Общий риск ВТЭ у женщин, принимающих низкодозированные КОК (<: 0,05 мг этинилэстрадиола) в два-три раза выше, чем у небеременных пациенток, которые не принимают КОК, тем не менее этот риск остается более низким по сравнению с риском ВТЭ во время беременности и родов.ВТЭ может оказаться жизнеугрожающей или привести к летальному исходу (в 1-2% случаев).ВТЭ, проявляющаяся в виде тромбоза глубоких вен или эмболии легочной артерии, может произойти при применении любых КОК. Крайне редко при применении КОК возникает тромбоз других кровеносных сосудов, например, печеночных, брыжеечных, почечных, мозговых вен и артерий или сосудов сетчатки. Симптомы тромбоза глубоких вен: односторонний отек нижней конечности или отек вдоль вены на нижней конечности, боль или дискомфорт в нижней конечности только в вертикальном положении или при ходьбе, локальное повышение температуры в пораженной нижней конечности, покраснение или изменение окраски кожных покровов на нижней конечности. Симптомы тромбоэмболии легочной артерии: затрудненное или учащенное дыхание: внезапный кашель, в том числе с кровохарканием: острая боль в грудной клетке, которая может усиливаться при глубоком вдохе: чувство тревоги: сильное головокружение: учащенное или нерегулярное сердцебиение. Некоторые из этих симптомов (например, одышка, кашель) являются неспецифическими и могут быть истолкованы неверно как признаки других более или менее тяжелых состояний/заболеваний (например, инфекции дыхательных путей). Артериальная тромбоэмболия может привести к инсульту, окклюзии сосудов или инфаркту миокарда. Симптомы инсульта: внезапная слабость или потеря чувствительности лица, конечностей, особенно с одной стороны тела, внезапная спутанность сознания, проблемы с речью и пониманием: внезапная одно- или двухсторонняя потеря зрения: внезапное нарушение походки, головокружение, потеря равновесия или координации движений: внезапная, тяжелая или продолжительная головная боль без видимой причины: потеря сознания или обморок с эпилептическим припадком или без него. Другие признаки окклюзии сосудов: внезапная боль, отечность и слабое посинение конечностей, "острый" живот. Симптомы инфаркта миокарда: боль, дискомфорт, давление, тяжесть, чувство сжатия или распирания в груди или за грудиной, с иррадиацией в спину, челюсть, левую верхнюю конечность, область эпигастрия: холодный пот, тошнота, рвота или головокружение, сильная слабость, тревога или одышка: учащенное или нерегулярное сердцебиение. Артериальная тромбоэмболия может оказаться жизнеугрожающей или привести к летальному исходу.У женщин с сочетанием нескольких факторов риска или высокой выраженностью одного из них следует рассматривать возможность их взаимоусиления. В подобных случаях суммарное значение имеющихся факторов риска повышается. В этом случае прием препарата Ярина® противопоказан (см. раздел "Противопоказания"). Риск развития тромбоза (венозного и/или артериального) и тромбоэмболии или цереброваскулярных нарушений повышается- с возрастом- у курящих (с увеличением количества выкуриваемых сигарет или повышением возраста риск нарастает, особенно у женщин старше 35 лет):при наличии- ожирения (индекс массы тела более чем 30 кг/м 2)- семейного анамнеза (например, венозной или артериальной тромбоэмболии когда-либо у близких родственников или родителей в относительно молодом возрасте). В случае наследственной или приобретенной предрасположенности женщина должна быть осмотрена соответствующим специалистом для решения вопроса о возможности приема препарата Ярина®- длительной иммобилизации, обширного хирургического вмешательства, любой операции на нижних конечностях или обширной травмы. В этих случаях прием препарата Ярина® необходимо прекратить (в случае планируемой операции по крайней мере за четыре недели до нее) и не возобновлять прием в течение двух недель после окончания иммобилизации. Временная иммобилизация (например, авиаперелет длительностью более 4 часов) может также являться фактором риска развития венозной тромбоэмболии, особенно при наличии других факторов риска- дислипопротеинемии- артериальной гипертензии- мигрени- заболеваний клапанов сердца- фибрилляции предсердий. Вопрос о возможной роли варикозного расширения вен и поверхностного тромбофлебита в развитии ВТЭ остается спорным. Следует учитывать повышенный риск развития тромбоэмболий в послеродовом периоде. Нарушения периферического кровообращения также могут отмечаться при сахарном диабете, системной красной волчанке, гемолитико-уремическом синдроме, хронических воспалительных заболеваниях кишечника (болезнь Крона или язвенный колит) и серповидно-клеточной анемии. Увеличение частоты и тяжести мигрени во время применения КОК (что может предшествовать цереброваскулярным нарушениям) является основанием для немедленной отмены приема этих препаратов.К биохимическим показателям, указывающим на наследственную или приобретенную предрасположенность к венозному или артериальному тромбозу относится следующее: резистентность к активированному протеину С, гипергомоцистеинемия, дефицит антитромбина III, дефицит протеина С, дефицит протеина S, антифосфолипидные антитела (антитела к кардиолипину, волчаночный антикоагулянт). При оценке соотношения риска и пользы следует учитывать, что адекватное лечение соответствующего состояния может уменьшить связанный с ним риск тромбоза. Также следует учитывать, что риск тромбозов и тромбоэмболий при беременности выше, чем при приеме низкодозированных пероральных контрацептивов (<: 0,05 мг этинилэстрадиола). Опухоли. Наиболее существенным фактором риска развития рака шейки матки является персистирующая папилломавирусная инфекция. Имеются сообщения о некотором повышении риска развития рака шейки матки при длительном применении КОК. Однако связь с приемом КОК не доказана. Обсуждается возможность взаимосвязи этих данных со скринингом заболеваний шейки матки или с особенностями полового поведения (более редкое применение барьерных методов контрацепции). Мета-анализ 54 эпидемиологических исследований показал, что имеется несколько повышенный относительный риск развития рака молочной железы, диагностированного у женщин, принимающих КОК в настоящее время (относительный риск 1,24). Повышенный риск постепенно исчезает в течение 10 лет после прекращения приема этих препаратов. В связи с тем, что рак молочной железы отмечается редко у женщин до 40 лет, увеличение числа диагнозов рака молочной железы у женщин, принимающих КОК в настоящее время или принимавших недавно, является незначительным но отношению к общему риску этого заболевания. Его связь с приемом КОК не доказана. Наблюдаемое повышение риска может быть также следствием тщательного наблюдения и более ранней диагностики рака молочной железы у женщин, применяющих КОК. У женщин, когда-либо использовавших КОК, выявляются более ранние стадии рака молочной железы, чем у женщин, никогда их не применявших.В редких случаях на фоне применения КОК наблюдалось развитие доброкачественных, а в крайне редких - злокачественных опухолей печени, которые в отдельных случаях приводили к угрожающему жизни внутрибрюшному кровотечению. В случае появления сильных болей в области живота, увеличения печени или признаков внутрибрюшного кровотечения это следует учитывать при проведении дифференциального диагноза. Злокачественные опухоли могут оказаться жизнеугрожающими или привести к летальному исходу. Другие состояния. Прогестиновый компонент в препарате Ярина® является антагонистом альдостерона, обладающим калийсберегающими свойствами. В большинстве случаев не должно наблюдаться повышения концентрации калия в плазме крови. В клинических исследованиях у некоторых пациенток с легкой или умеренной почечной недостаточностью и сопутствующем приеме калийсберегающих препаратов концентрация калия в плазме крови незначительно повышалась во время приема дроспиренона. Поэтому концентрацию калия в плазме крови необходимо контролировать в течение первого цикла приема препарата у пациенток с почечной недостаточностью и при изначальной концентрации калия на верхней границе нормы, особенно при сопутствующем приеме калийсберегающих препаратов (см. раздел "Взаимодействие с другими лекарственными препаратами").У женщин с гипертриглицеридемией (или наличием этого состояния в семейном анамнезе) возможно повышение риска развития панкреатита во время приема КОК. Несмотря на то, что небольшое повышение артериального давления было описано у многих женщин, принимающих КОК, клинически значимые повышения отмечались редко. Тем не менее, если во время приема препарата развивается стойкое, клинически значимое повышение артериального давления, следует отменить эти препараты и начать лечение артериальной гипертензии. Прием препарата может быть продолжен, если с помощью гипотензивной терапии достигнуты нормальные значения артериального давления. Следующие состояния, как сообщалось, развиваются или ухудшаются как во время беременности, так и при приеме КОК, но их связь с приемом КОК не доказана: желтуха и/или зуд, связанный с холестазом: формирование камней в желчном пузыре: порфирия: системная красная волчанка: гемолитико-уремический синдром: хорея Сиденгама: герпес во время беременности: потеря слуха, связанная с отосклерозом. Также описаны случаи ухудшения течения эндогенной депрессии, эпилепсии, болезни Крона и язвенного колита на фоне применения КОК.У женщин с наследственными формами ангионевротического отека экзогенные эстрогены могут вызывать или ухудшать симптомы ангионевротического отека. Острые или хронические нарушения функции печени могут потребовать отмены препарата до тех пор, пока показатели функции печени не вернутся в норму. Рецидив холестатической желтухи, развившейся впервые во время предшествующей беременности или предыдущего приема половых гормонов, требует прекращения приема препарата. Хотя КОК могут оказывать влияние на инсулинорезистентность и толерантность к глюкозе, необходимости в коррекции дозы гипогликемических препаратов у пациенток с сахарным диабетом, использующих низкодозированные КОК (<:0,05 мг этинилэстрадиола), как правило, не возникает. Тем не менее женщины с сахарным диабетом должны тщательно наблюдаться во время приема КОК. Иногда может развиваться хлоазма, особенно у женщин с наличием в анамнезе хлоазмы беременных. Женщины со склонностью к хлоазме во время приема препарата Ярина® должны избегать длительного пребывания на солнце и воздействия ультрафиолетового излучения. Доклинические данные по безопасности. Доклинические данные, полученные в ходе стандартных исследований на предмет выявления токсичности при многократном приеме доз препарата, а также генотоксичности, канцерогенного потенциала и токсичности для репродуктивной системы, не указывают на наличие особого риска для человека. Тем не менее следует помнить, что половые гормоны могут способствовать росту некоторых гормонозависимых тканей и опухолей. Лабораторные тесты. Прием препарата Ярина® может влиять на результаты некоторых лабораторных тестов, включая показатели функции печени, почек, щитовидной железы, надпочечников, концентрацию транспортных белков в плазме, показатели углеводного обмена, параметры свертывания крови и фибринолиза. Изменения обычно не выходят за границы нормальных значений. Дроспиренон увеличивает активность ренина плазмы и концентрацию альдостерона, что связано с его антиминералокортикоидным эффектом. Снижение эффективности. Эффективность препарата Ярина® может быть снижена в следующих случаях: при пропуске таблеток, желудочно-кишечных расстройствах или в результате лекарственного взаимодействия. Частота и выраженность менструальноподобных кровотечений. На фоне приема препарата Ярина® могут наблюдаться нерегулярные (ациклические) кровотечения из влагалища ("мажущие" кровянистые выделения и/или "прорывные" маточные кровотечения), особенно в течение первых месяцев применения. Поэтому оценка любых нерегулярных менструальноподобных кровотечений должна проводиться после периода адаптации, составляющего приблизительно три цикла. Если нерегулярные менструальноподобные кровотечения повторяются или развиваются после предшествующих регулярных циклов, следует провести тщательное обследование для исключения злокачественных новообразований или беременности.У некоторых женщин во время перерыва в приеме таблеток может не развиться кровотечения "отмены". Если препарат Ярина® принимался согласно рекомендациям, маловероятно, что женщина беременна. Тем не менее при нерегулярном применении препарата и отсутствии двух подряд менструальноподобных кровотечений прием препарата не может быть продолжен до исключения беременности. Медицинские осмотры. Перед началом или возобновлением применения препарата Ярина® необходимо ознакомиться с анамнезом жизни, семейным анамнезом женщины, провести тщательное общемедицинское и гинекологическое обследование, исключить беременность. Объем исследований и частота контрольных осмотров должны основываться на существующих нормах медицинской практики при необходимом учете индивидуальных особенностей каждой пациентки. Как правило, измеряется артериальное давление, частота сердечных сокращений, определяется индекс массы тела, проверяется состояние молочных желез, брюшной полости и органов малого таза, включая цитологическое исследование эпителия шейки матки (тест по Папаниколау). Обычно контрольные обследования следует проводить не реже 1 раза в 6 месяцев. Необходимо иметь в виду, что препарат Ярина® не предохраняет от ВИЧ-инфекции (СПИД) и других заболеваний, передающихся половым путем. Состояния, требующие консультации врача- какие-либо изменения в здоровье, особенно возникновение состояний, перечисленных в разделах "Противопоказания" и "Применение с осторожностью"- локальное уплотнение в молочной железе- одновременный прием других лекарственных препаратов (см. также "Взаимодействие с другими лекарственными средствами")- если ожидается длительная неподвижность (например, на нижнюю конечность наложен гипс), планируется госпитализация или операция (по крайней мере за 4 недели до предполагаемой операции)- необычно сильное кровотечение из влагалища- пропущена таблетка в первую неделю приема упаковки и был половой контакт за семь или менее дней до этого- отсутствие очередного менструальноподобного кровотечения два раза подряд или подозрение на беременность (не следует начинать прием таблеток из следующей упаковки до консультации с врачом). Следует прекратить прием таблеток и немедленно проконсультироваться с врачом, если имеются возможные признаки тромбоза, инфаркта миокарда или инсульта: необычный кашель: необычно сильная боль за грудиной, отдающая в левую руку: неожиданно возникшая одышка, необычная, сильная и длительная головная боль или приступ мигрени: частичная или полная потеря зрения или двоение в глазах: нечленораздельная речь: внезапные изменения слуха, обоняния или вкуса: головокружение или обморок: слабость или потеря чувствительности и любой части тела: сильная боль в животе: сильная боль в нижней конечности или внезапно возникший отек любой из нижних конечностей. Влияние на способность управлять транспортными средствами: Не выявлено. Условия хранения и отпуска из аптек Условия хранения:Хранить при температуре не выше 25 °С. Хранить в недоступном для детей месте. Отпуск из аптек: По рецепту Регистрационные данные Торговое название Ярина® Международное непатентованное название:Дроспиренон + Этинилэстрадиол. Форма выпуска:таблетки, покрытые пленочной оболочкой. Состав: Каждая таблетка, покрытая пленочной оболочкой, содержит:Ядро таблетки:активные вещества: этинилэстрадиол - 30 мкг, дроспиренон - 3 мг:вспомогательные вещества: лактозы моногидрат - 48,170 мг, крахмал кукурузный - 14,400 мг, крахмал кукурузный прежелатинизированный - 9,600 мг, повидон К25 - 4,000 мг, магния стеарат - 800 мкг. Оболочка таблетки: гипромеллоза (гидроксипропилметилцеллюлоза) - 1,0112 мг, макрогол 6000 - 202,4 мкг, тальк (магния гидросиликат) - 202,4 мкг, титана диоксид (Е 171) - 556,5 мкг, железа (II) оксид (Е 172) - 27,5 мкг. АТХ: Регистрация: Лекарственное средство П N013882/01 Фармгруппа: контрацептивное средство комбинированное (эстроген+гестаген)Дата регистрации: 02.04.2008 / 11.09.2014. Окончание регстрации: . Описание:Таблетки, покрытые пленочной оболочкой, светло-желтого цвета, с одной стороны выгравирован шестиугольник, внутри которого буквы "DO". Упаковка:Таблетки, покрытые пленочной оболочкой, 3 мг + 0,03 мг. По 21 таблетке помещают в блистер из алюминиевой фольги и поливинилхлоридной пленки. 1 или 3 блистера вместе с кармашком для ношения блистера с инструкцией по применению помещают в картонную пачку. Срок годности:3 года. Не применять по истечении срока годности. Владелец рег.удостоверения:Байер Фарма АГ Производитель:BAYER PHARMA, AG. Представительство:БАЙЕР, АО. Информация предоставлена: Компанией ГЭОТАР - http://www.lsgeotar.ru/
